天然产物一直是新药研发的重要来源,在寻找药物先导化合物方面发挥着不可或缺的作用。与传统化学药物相比,天然产物具有良好的生物活性、独特的作用机理、良好的生物兼容性以及低毒性,并逐渐成为目前抗菌药物领域的研究热点之一。同时,对来源易得的天然产物进行结构改造以期从中发现新的高活性先导化合物是新药研究与开发的重要有效途径之一。
小檗碱是从传统中药黄连中分离获得的异喹啉类生物碱,具有抗炎、抗肿瘤等多种药理活性。尽管目前已有多篇小檗碱衍生物在抗菌方面的报道,但对小檗碱结构衍生物在农用真菌方面的研究还相对较少。
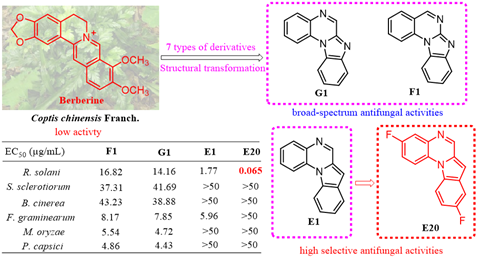
近日,兰州大学药学院刘映前教授团队在小檗碱衍生物抗农用真菌方面的研究取得新进展。相关研究成果 “Design, synthesis, and biological evaluation of novel berberine derivatives against phytopathogenic fungi” 发表在Pest Management Science(SCI 1区TOP期刊,IF=4.462)期刊上。兰州大学药学院硕士研究生周勇和博士研究生杨程杰为该论文共同第一作者,通讯作者为刘映前教授和张智军老师,兰州大学药学院为该论文的第一单位。该研究以小檗碱为先导模型,通过其骨架跃迁策略构建了全新分子骨架,进一步丰富了抗菌分子新骨架结构,拓展了小檗碱的“化学空间”,为防治植物病原真菌感染提供了新策略。

研究团队采用生物电子等排以及骨架跃迁等结构优化策略设计合成了七类小檗碱系列衍生物 A1 ~ G1 (Figure 1)。
Figure 1. Structures of berberine derivatives A1 ~ G1.
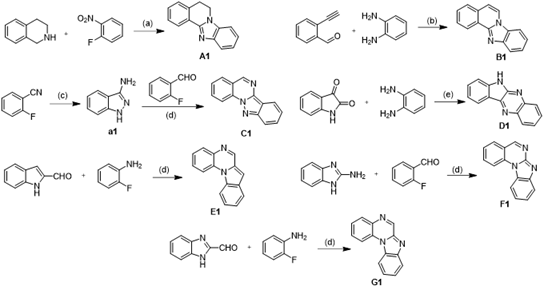
Scheme 1. Synthetic Procedure for Target Compounds A1 ~ G1.
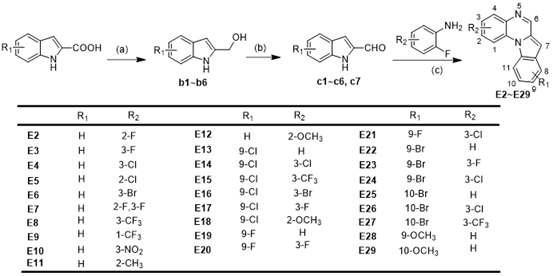
Scheme 2. Synthetic Procedure for Target Compounds E2 ~ E29.
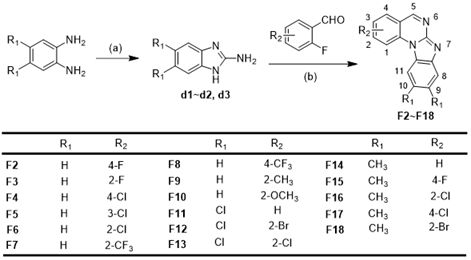
Scheme 3. Synthetic Procedure for Target Compounds F2 ~ F18.
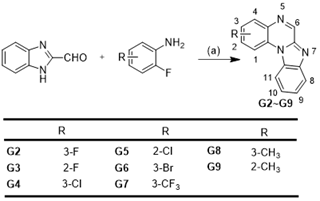
Scheme 4. General Synthetic Procedure for Target Compounds G2 ~ G9.
作者首先评估了所得化合物A1~G1 对立枯丝核病原菌、油菜菌核病原菌、番茄灰霉病原菌、小麦赤霉病原菌、水稻稻瘟病原菌和辣椒疫霉病原菌六种植物病原真菌的体外抗菌活性 (Table 2)。筛选结果显示化合物E1 对立枯丝核病原菌具有较好的抗菌活性,其 EC50值为1.77 μg ml−1;化合物 F1 和 G1 对六种病原真菌具有广谱抗菌活性,其EC50 值在4.43 到 42.23 μg ml−1之间。在此基础上,作者对E1、F1和G1三个系列化合物进行了进一步的结构优化研究,设计合成了 E2~E29、 F2~F18和G2~G9等化合物(Scheme 2, 3, 4),并评估了这些化合物的体外抗菌活性。体外抗菌活性结果显示:化合物 E20 对立枯丝核病原菌表现出极强的抗菌活性,其EC50 值达到了0.065 μg ml−1,与立枯丝核病原菌特效药噻呋酰胺 (EC50=0.054 μg ml−1) 的抗菌活性相当(Table 4, 6)。因此,作者进一步高活性化合物E20 进行作用机制研究。
Table 2. EC50 Values of Berberine Derivatives E1, F1, and G1.
compdounds | fungi | EC50 (μg/mL) | 95% CI | regression equation | R2 |
E1 | R. solani | 1.77 | 1.45-2.13 | y=-0.66+2.49x | 0.968 |
S. sclerotiorum | >50 | -b | - | - |
B. cinerea | >50 | - | - | - |
F. graminearum | 5.96 | 1.12-10.56 | y=-0.67+0.87x | 0.889 |
M. oryzae | >50 | - | - | - |
P. capsici | >50 | - | - | - |
F1 | R. solani | 16.82 | 14.01-20.53 | y=-3.11+2.55x | 0.982 |
S. sclerotiorum | 37.34 | 31.60-46.27 | y=-6.00+3.81x | 0.987 |
B. cinerea | 43.23 | 35.10-57.53 | y=-5.12+3.15x | 0.975 |
F. graminearum | 8.17 | 6.85-9.51 | y=-3.99+4.35x | 0.959 |
M. oryzae | 5.54 | 1.38-13.19 | y=-2.77+3.83x | 0.949 |
P. capsici | 4.86 | 1.00-10.91 | y=-3.35+5.02x | 0.943 |
G1 | R. solani | 14.16 | 11.44-17.82 | y=-2.52+2.16x | 0.971 |
S. sclerotiorum | 41.69 | 31.85-60.55 | y=-3.65+2.27x | 0.983 |
B. cinerea | 38.88 | 30.75-53.94 | y=-4.33+2.75x | 0.945 |
F. graminearum | 7.85 | 6.02-9.97 | y=-1.64+1.82x | 0.989 |
M. oryzae | 4.72 | 3.96-5.50 | y=-2.35+3.48x | 1.000 |
P. capsici | 4.43 | 3.76-5.12 | y=-2.32+3.56x | 0.967 |
Thiophanate-methyl | R. solani | 6.76 | 2.97-12.90 | y=-3.13+3.52x | 0.909 |
S. sclerotiorum | <1 | - | - | - |
B. cinerea | >50 | - | - | - |
F. graminearum | 22.12 | 19.25-25.95 | y=-5.44+1.78x | 0.980 |
M. oryzae | 10.35 | 8.79-12.02 | y=-3.98+3.93x | 0.986 |
P. capsici | 6.88 | 6.12-7.74 | y=-4.40+5.17x | 0.995 |
R. solani, Rhizoctonia solani; S. sclerotiorum, Sclerotinia sclerotiorum; B. cinerea, Botrytis cinerea; F. graminearum, Fusarium graminearum; M. oryzae, Magnaporthe oryzae; P. capsici, Phytophthora capsici. All values are the mean of three replicates, and “-” means not measured or calculated
Table 4. EC50 Values of Berberine Derivatives E2~E29 against R. solani.
compounds | EC50 (μg/mL) | 95% CI | regression equation | R2 |
E2 | 0.60 | 0.32-0.88 | y=0.32+1.37x | 0.925 |
E3 | 0.24 | 0.18-0.32 | y=0.96+1.57x | 0.992 |
E4 | 0.96 | 0.43-1.52 | y=0.02+0.94x | 0.974 |
E5 | > 50 | - | - | - |
E6 | 26.48 | 20.63-36.45 | y=-2.75+1.93x | 0.991 |
E7 | > 50 | - | - | - |
E8 | > 50 | - | - | - |
E9 | 18.53 | 12.02-34.70 | y=0.77+0.61x | 0.844 |
E10 | > 50 | - | - | - |
E11 | 16.57 | 8.39-49.78 | y=-1.94+1.58x | 0.913 |
E12 | 21.36 | 15.39-33.30 | y=-1.90+1.36x | 0.987 |
E13 | > 50 | - | - | - |
E14 | > 50 | - | - | - |
E15 | > 50 | - | - | - |
E16 | > 50 | - | - | - |
E17 | > 50 | - | - | - |
E18 | > 50 | - | - | - |
E19 | 0.098 | 0.080-0.12 | y=2.42+2.40x | 0.981 |
E20 | 0.065 | 0.055-0.078 | y=3.35+2.82x | 0.991 |
E21 | 0.073 | 0.061-0.088 | y=3.00+2.62x | 0.969 |
E22 | 14.19 | 11.48-17.83 | y=-2.52+2.17x | 0.978 |
E23 | 4.38 | 3.44-5.65 | y=-1.12+1.70x | 0.956 |
E24 | 32.10 | 24.77-45.37 | y=-3.11+2.07x | 0.992 |
E25 | 10.73 | 8.66-13.30 | y=-2.20+2.13x | 0.975 |
E26 | 19.59 | 15.35-26.27 | y=-2.39+1.85x | 0.990 |
E27 | > 50 | - | - | - |
E28 | 3.80 | 1.18-6.64 | y=-0.46+0.80x | 0.811 |
E29 | > 50 | - | - | - |
Thifluzamide | 0.054 | 0.041-0.071 | y=1.65x+2.08 | 0.972 |
Table 6. EC50 Values of Berberine Derivatives F10, G2, G3 and G9 against the Six Tested Phytopathogenic Fungi.
compounds | fungi | EC50 (μg/mL) | 95% CI | regression equation | R2 |
F10 | R. solani | 13.08 | 10.22-17.04 | y=-2.00+1.78x | 0.991 |
S. sclerotiorum | 19.34 | 14.58-26.69 | y=-2.18+1.69x | 0.993 |
B. cinerea | 22.56 | 16.88-32.99 | y=-2.19+1.61x | 0.961 |
F. graminearum | 7.28 | 3.98-11.91 | y=-2.44+2.75x | 0.937 |
M. oryzae | 12.48 | 9.62-16.43 | y=-1.80+1.67x | 0.973 |
P. capsici | 9.63 | 3.01-25.82 | y=1.79x-1.78 | 0.882 |
G2 | R. solani | 5.31 | 1.35-10.12 | y=-1.10+1.51x | 0.898 |
S. sclerotiorum | 42.89 | 33.50-61.28 | y=-4.43+2.75x | 0.944 |
B. cinerea | >50 | - | - | - |
F. graminearum | 6.88 | 2.42-13.62 | y=-1.94+2.26x | 0.902 |
M. oryzae | 6.97 | 5.49-8.79 | y=-1.81+2.13x | 0.943 |
P. capsici | 6.75 | 3.22-11.54 | y=-2.00+2.36x | 0.931 |
G3 | R. solani | 13.30 | 10.90-16.39 | y=-2.62+2.31x | 0.986 |
S. sclerotiorum | 27.04 | 13.84-119.39 | y=-4.79+3.33x | 0.947 |
B. cinerea | >50 | - | - | - |
F. graminearum | 5.97 | 4.91-7.12 | y=-2.38+3.09x | 0.962 |
M. oryzae | 6.05 | 5.19-7.01 | y=-2.97+3.85x | 0.987 |
P. capsici | 5.63 | 4.84-6.51 | y=-2.87+3.78x | 0.993 |
G9 | R. solani | 10.80 | 5.46-21.38 | y=-1.92+1.83x | 0.922 |
S. sclerotiorum | >50 | - | - | - |
B. cinerea | >50 | - | - | - |
F. graminearum | 5.03 | 0.68-10.58 | y=-1.19+1.68x | 0.872 |
M. oryzae | 7.80 | 6.27-9.80 | y=-2.03+2.27x | 0.989 |
P. capsici | 5.79 | 4.68-7.02 | y=-1.96+2.56x | 0.992 |
Thiophanate-methyl | R. solani | 6.39 | 5.72-7.15 | y=-4.73+5.71x | 0.989 |
S. sclerotiorum | <1 | - | - | - |
B. cinerea | >50 | - | - | - |
F. graminearum | 18.54 | 10.96-46.16 | y=-0.95+0.75x | 0.988 |
M. oryzae | 20.08 | 12.53-39.77 | y=-5.47+4.10x | 0.967 |
P. capsici | 11.01 | 9.21-13.20 | y=-2.79+2.69x | 0.997 |
R. solani, Rhizoctonia solani; S. sclerotiorum, Sclerotinia sclerotiorum; B. cinerea, Botrytis cinerea; F. graminearum, Fusarium graminearum; M. oryzae, Magnaporthe oryzae; P. capsici, Phytophthora capsici. All values are the mean of three replicates, and “-” means not measured or calculated
扫描电子显微镜结果显示:对照组的菌丝体光滑且形状规则 (Figure 3a,3b)。化合物E20处理后,菌丝形态发生明显变化,菌丝体表面严重收缩、塌陷和粗糙 (Figure. 3c,3d)。
透射电子显微镜结果显示:对照组菌丝细胞细胞器丰富,细胞质分布均匀,细胞膜、细胞壁和线粒体结构完整 (Figure 4a,4b)。而化合物E20处理后,立枯丝核病原菌的细胞壁和细胞膜遭到破坏,线粒体、叶泡等细胞器功能异常 (Figure 4c,4d),最终导致细胞死亡。
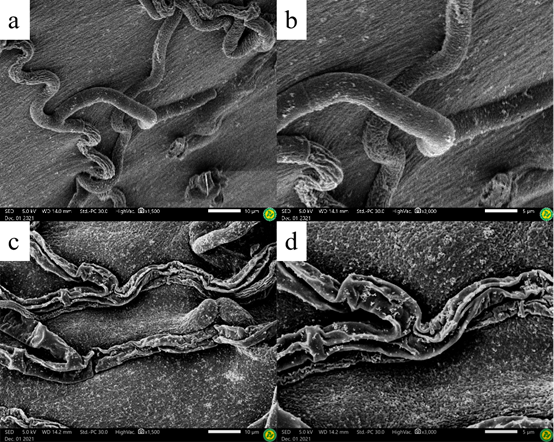
Figure 3. Scanning electron micrographs of the mycelia from the colony of R. solani. (a) Blank control, 0.5%DMSO, ×1500. (b) Blank control, 0.5%DMSO, ×3000. (c) Treated with 0.5% DMSO plus compound E20 at 0.1 μg/mL, ×1500. (d) Treated with 0.5% DMSO plus compound E20 at 0.1 μg/mL, ×3000.
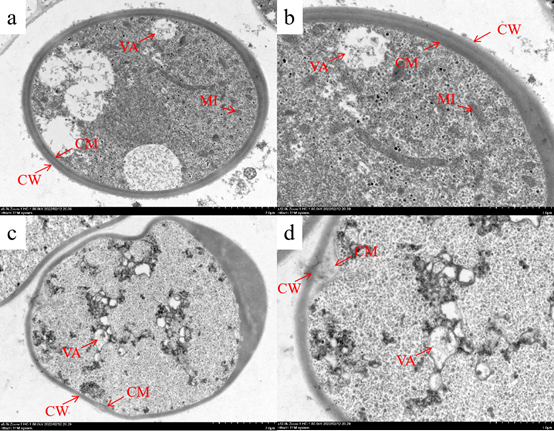
Figure 4. Transmission electron microscopy observations of cell structure of R. solani. (a) Blank control, 0.5% DMSO, ×6000. (b) Blank control, 0.5% DMSO, ×12000. (c) Treated with 0.5% DMSO plus compound E20 at 0.1 μg/mL, ×6000. (d) Treated with 0.5% DMSO plus compound E20 at 0.1 μg/mL, ×12000. VA: vacuole; CW: cell wall; CM: cell membrane; MI: mitochondria. After treatment, the cell wall and cell membrane of R. solani were obviously damaged, distorted or thickened, the mitochondrial disappeared, and the vacuole was abnormal.
ROS荧光染色(Figure 5a,5b) 和PI荧光染色(Figure 5c,5d) 结果显示:与对照组相比,化合物E20处理后,可增加立枯丝核病原菌细胞内源活性氧的产生,破坏其细胞膜的完整性。
Figure 5. Effects of compound E20 on the reactive oxygen species (a, b) and cell membrane integrity (c, d) of R. solani mycelia. (a and c) Blank control, 0.5% DMSO; (b and d) Treated with 0.5% DMSO plus compound E20 at 0.1 μg/mL.
活体实验结果显示:化合物E20 对立枯丝核病原菌引起的病害具有有效的体内抗真菌活性,可进一步用于预防立枯丝核病原菌引起的真菌性病害。其中,在给药浓度为5 μg ml−1的情况下,化合物E20 对活体的保护作用优于商业化药噻呋酰胺 (Figure 6),治疗作用与商业化药噻呋酰胺相当 (Figure 7)。
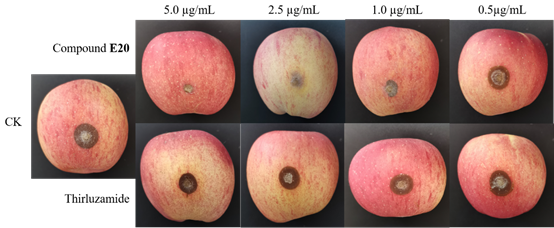
Figure 6. In vivo protective effects of the compound E20 and thirluzamide against R. solani.
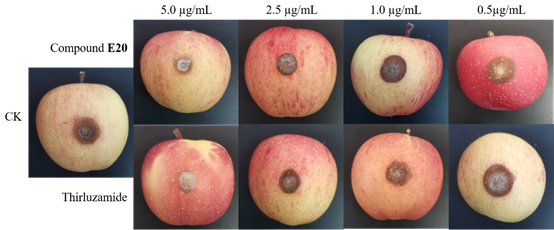
Figure 7. In vivo curative effects of the compound E20 and thirluzamide against R. solani.
综上,基于天然产物小檗碱,刘映前教授团队采用生物电子等排以及骨架跃迁等结构优化策略设计合成了七类小檗碱系列衍生物 (A1~G1),并评估了所得化合物对立枯丝核病原菌、油菜菌核病原菌、番茄灰霉病原菌、小麦赤霉病原菌、水稻稻瘟病原菌和辣椒疫霉病原菌六种病原菌的体外抗菌活性,得到了两类广谱抗真菌骨架 F1和 G1以及特异性抗立枯丝核病原菌骨架 E1。
在对E1、 F1和 G1三个系列的进一步结构优化中,得到了对立枯丝核病原菌具有更好抗菌活性的高活性先导化合物 E20,其 EC50值为0.065 μg ml−1,与立枯丝核病原菌特效药噻呋酰胺 (EC50=0.054 μg ml−1) 抗菌活性相当。化合物E20的初步机制研究结果显示:小檗碱衍生物 E20 可导致立枯丝核菌菌丝皱缩、扭曲、塌陷,细胞膜和细胞壁严重破损,细胞线粒体异常,最终引起细胞死亡。活体实验结果显示:化合物 E20可进一步用于预防立枯丝核病原菌引起的病害。
这项研究的重要进展为小檗碱类生物碱在农用真菌方面的研究提供了新思路,为进一步开发源于小檗碱启发性获得的高活性活性先导E20在农用抗菌剂开发方面奠定基础。该项研究工作得到了国家重点研发计划、国家自然科学基金、浙江省优势特色学科重点项目、甘肃省国际科技合作重点项目等项目的共同资助。该项研究也是课题组近年来依托甘肃省中藏药功效物质开发与利用行业技术中心,开展源于天然源中藏药资源进行全新抗菌药物开发研究取得的一系列重要科研成果,对于推动中藏药功效物质开发与新药创制具有重要意义。
原文连接:https://doi.org/10.1002/ps.7055