农作物的高产稳产是人类发展和社会稳定的基础,而害虫是造成农作物减产的主要因素之一。杀虫剂因其适用于大面积防治害虫且使用方便等优点在农业害虫防治中起到巨大作用。但由于现有杀虫剂的大量及不合理使用,导致害虫抗性增加、危害环境等问题,迫切需要开发结构新颖、活性好、用量低、环境友好的新型杀虫剂。
介离子类化合物是一类五元或六元偶极杂环化合物,该类化合物在抗炎、抗抑郁、抗肿瘤等领域应用广泛,近十几年来在杀虫剂领域也成为了新的研究热点。杜邦公司(现科迪华)在2008年首次披露了具有杀虫活性的介离子化合物,这类化合物具有全新化学结构和作用机理,三氟苯嘧啶(triflumezopyrim,见图1)作为首个该类杀虫剂是科迪华公司专为亚太地区开发的品种,可用于大豆、棉花、玉米和水稻等作物,对鳞翅目、同翅目等多种害虫有很好防效。
双酰胺类杀虫剂是一类以芳香环为核心,在芳香环的2个不同位点分别连接一个酰胺键的活性分子。其中,间二酰胺类化合物与传统双酰胺类化合物不同,具有结构新颖、广谱高效、环境友好、与现有杀虫剂无交互抗性等特点,因而受到广泛关注。南通泰禾化工股份有限公司研发出的环丙氟虫胺(cyproflanilide,见图1),对水生生物安全性好,与现有杀虫剂无交互抗性,对鳞翅目二化螟、小菜蛾、稻纵卷叶螟等多种害虫具有显著防效。
本课题组在环丙氟虫胺结构基础上,采用活性亚结构拼接法,将介离子结构与间二酰胺化合物相结合,首先设计合成化合物1a~1f,根据生物活性测试结果反馈和分子结构对比,再将化合物1a~1f中分子量较大基团A部分整体替换成环丙基、甲基环丙基、环丙甲基这些分子量较小的基团,进一步设计合成化合物2a~2i,见图1。目标化合物的结构均经过1H NMR和HRMS确证。
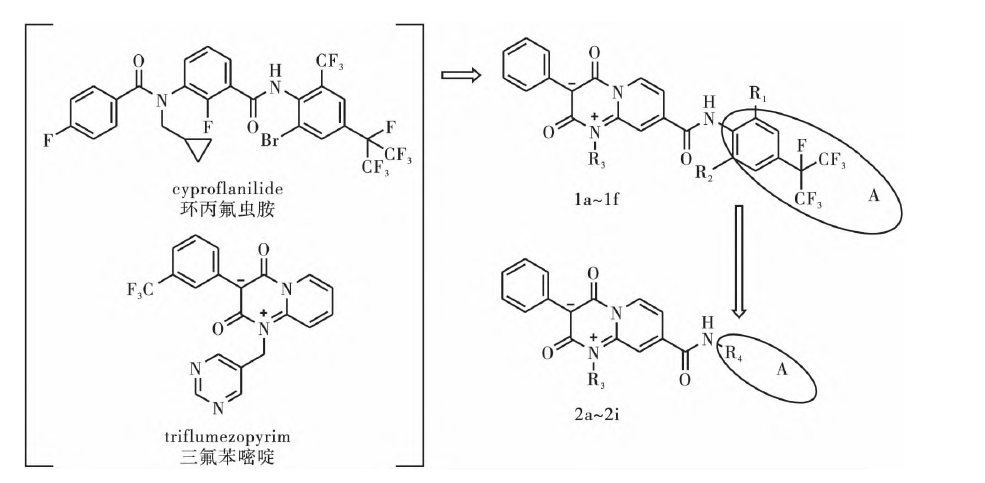
图1 新型介离子类酰胺化合物的设计
1. 仪器与试剂
Mercury 400(Varian)或Mercury 500(Varian)型核磁共振仪,四甲基硅烷(TMS)为内标,DMSO-d6或CDCl3为溶剂;Agilent 1290-6230 TOF高分辨质谱仪(HRMS);Agilent1260-6120 Quadrupole液相-质谱仪(LRMS);层析硅胶(GF245)薄板(涤纶片基,5 cm×10 cm);快速柱层析用硅胶(ZCX-II,106~150 μm),青岛海洋化工厂。所用溶剂和试剂均为市售分析纯或化学纯,必要时经过干燥或蒸馏处理。
2. 目标化合物的合成
目标化合物的合成路线见图2、3。
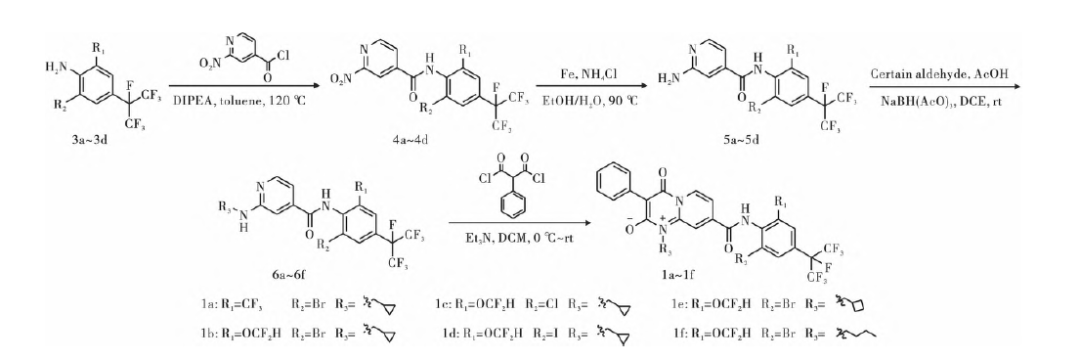
图2 目标化合物1a~1f的合成路线
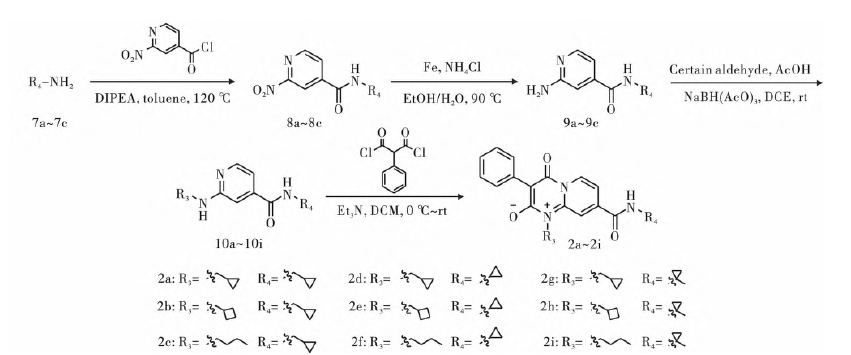
图3 目标化合物2a~2i的合成路线
(1)中间体4~6和8~10的合成方法
中间体4a的合成:将2-溴-4-(全氟丙烷-2-基)-6-(三氟甲基)苯胺3a(7.26 g,17.79 mmol)、甲苯(70 mL)、N,N-二异丙基乙胺(4.60 g,35.59 mmol)、2-硝基异烟酰氯(3.65 g,19.57 mmol)依次加入250 mL反应瓶中,120 ℃搅拌反应4 h,TLC板监测。
反应完全后,停止反应,减压脱溶,用乙酸乙酯/水(200 mL/200 mL)萃取,取有机层,加硅胶拌样,柱层析,石油醚(PE)∶乙酸乙酯(EA)=3∶1(体积比),得到中间体4a(6.24 g,收率62%),为黄色固体。
采用与中间体4a类似的合成方法合成了中间体4b~4d和8a~8c。
中间体5a的合成:向250 mL反应瓶中依次加入中间体4a(6.24 g,11.18 mmol)、乙醇(35 mL)、水(35 mL)、铁粉(6.24 g,111.80 mmol)、氯化铵(5.97 g,111.80 mmol),90 ℃搅拌反应6 h,TLC跟踪。反应完全后,停止反应,过滤,减压脱溶,用乙酸乙酯/水(100 mL/100 mL)萃取,取有机层,加硅胶拌样,柱层析(PE∶EA=1∶1,体积比)得中间体5a(5.00g,收率85%),黄色固体。采用与中间体5a类似的合成方法合成了中间体5b~5d和9a~9c。
中间体6a的合成:向100 mL的反应瓶中依次加入中间体5a(2.00 g,3.79 mmol)、1,2-二氯乙烷(20 mL)、环丙甲醛(0.29 g,4.17 mmol)、乙酸(1.26 g,22.72 mmol),常温搅拌反应1 h后,分批加入三乙酰氧基硼氢化钠(2.14 g,11.36 mmol),继续常温搅拌,TLC板监测。反应完全后,加入饱和NaHCO3溶液,把pH调到8。
再用DCM/H2O(100 mL/100 mL)萃取,有机层减压浓缩,粗品经柱层析分离纯化(PE∶EA=1∶1,体积比)得中间体6a(1.40 g,收率64%),白色固体。采用与中间体6a类似的合成方法合成了中间体6b~6f和10a~10i。
(2)目标化合物1a~1f的合成
以化合物1a为例,将中间体N-(2-溴-4-(全氟丙烷-2-基)-6-(三氟甲基)苯基)-2-((环丙基甲基)氨基)-1,2-二氢吡啶-4-甲酰胺6a(515.25 μmol)、三乙胺(2.58 mmol)、二氯乙烷(5.0 mL)依次加入单口瓶中,在冰浴条件下搅拌0.5 h后缓慢滴加2-苯基丙二酰氯(515.25 μmol)的二氯乙烷(5.0 mL)溶液,滴加完毕后,升至室温继续搅拌至反应完全,TLC监测。加二氯甲烷(30.0 mL)和水(30.0 mL),萃取,取有机层,无水硫酸钠干燥,加适量硅胶拌样,柱层析,获得目标化合物1a。将中间体6a换成相应中间体即可得到化合物1b~1f。化合物的理化性质、1H NMR和HRMS数据如下:
化合物1a:黄色固体,收率37%,熔点>200 ℃;1H NMR(400 MHz,DMSO) δ:11.50(s,1H),9.47(d,J=7.2 Hz,1H),8.53(s,1H),8.30(s,1H),8.05(s,1H),7.86(dd,J=7.2,1.2 Hz,1H),7.72(d,J=7.2 Hz,2H),7.33(t,J=7.6 Hz,2H),7.18(t,J=7.6 Hz,1H),4.40~4.33(m,2H),1.26(s,1H),0.56~0.53(m,4H)。
HRMS(ESI)m/z:C29H18BrF10N3O3[M+H]+计算值726.0372,实测值726.0461。
化合物1b:黄色固体,收率35%,熔点197.5~198.8 ℃;1H NMR(400 MHz,DMSO) δ:11.23(s,1H),9.46(d,J=7.2 Hz,1H),8.31(s,1H),7.99(s,1H),7.87(d,J=8.4 Hz,1H),7.71(d,J=8.0 Hz,2H),7.64(d,J=2.4 Hz,1H),7.39(t,J=72.6 Hz,1H),7.32(t,J=7.6 Hz,2H),7.18(t,J=7.6 Hz,1H),4.37(d,J=6.8 Hz,2H),1.24(d,J=3.2 Hz,1H),0.54(d,J=6.4 Hz,4H)。
HRMS(ESI)m/z:C29H19BrF9N3O4[M+H]+计算值723.0415,实测值723.0386。
化合物1c:红色固体,收率37%,熔点160.0~160.8 ℃;1H NMR(400 MHz,DMSO) δ:11.20(s,1H),9.46(d,J=7.2 Hz,1H),8.33 (s,1H),8.08 (s,1H),7.88 (d,J =6.8 Hz,1H),7.73~7.69(m,2H),7.61(s,1H),7.39(t,J=72.6 Hz,1H),7.34(d,J=7.6 Hz,2H),7.19(d,J=7.6 Hz,1H),4.37(d,J=6.4 Hz,2H),3.53(q,J=7.2 Hz,1H),0.54(d,J=6.4 Hz,4H)。
HRMS(ESI)m/z:C29H19ClF9N3O4[M+H]+计算值680.0920,实测值680.0977。
化合物1d:黄色固体,收率30%,熔点>200 ℃;1H NMR(400 MHz,DMSO) δ:11.26(s,1H),9.46(d,J=7.2 Hz,1H),8.31(s,1H),7.92~7.85(m,2H),7.71(dd,J=8.4,1.2 Hz,2H),7.61 (s,1H),7.39 (t,J =72.6 Hz,1H),7.33 (t,J =7.6 Hz,2H),7.18(t,J=7.6 Hz,1H),4.36(d,J=6.8 Hz,2H),1.24(s,1H),0.54(d,J=6.4 Hz,4H)。
RMS(ESI)m/z:C29H19F9IN3O4[M+H]+计算值772.0277,实测值772.0197。
化合物1e:黄色固体,收率36%,熔点198.1~198.8 ℃;1H NMR(400 MHz,DMSO) δ:11.20(s,1H),9.44(d,J=7.2 Hz,1H),8.16(s,1H),7.99(d,J=1.2 Hz,1H),7.84(dd,J=7.2,1.2 Hz,1H),7.71(dd,J=8.4,1.2 Hz,2H),7.64(s,1H),7.39(t,J=72.6 Hz,1H),7.32(t,J=7.6 Hz,2H),7.18(dt,J=8.4,1.2 Hz,1H),4.51(d,J=6.4 Hz,2H),2.76 (dt,J=15.2,7.6 Hz,1H),2.01~1.95(m,2H),1.94~1.87(m,2H),1.82(dt,J=7.6,4.4 Hz,2H)。
HRMS(ESI)m/z:C30H21BrF9N3O4[M+H]+计算值738.0572,实测值738.0635。
化合物1f:红色固体,收率34%,熔点>200 ℃;1H NMR(400 MHz,DMSO) δ:11.22(s,1H),9.45(d,J=7.2 Hz,1H),8.12 (s,1H),7.99 (s,1H),7.85 (d,J =7.2 Hz,1H),7.74 ~7.70(m,2H),7.64(s,1H),7.39(t,J=72.6 Hz,1H),7.32(t,J=7.6 Hz,2H),7.20~7.15(m,1H),4.43~4.35(m,2H),1.72~1.65(m,2H),1.44(dd,J=14.8,7.6 Hz,2H),0.96(t,J=7.2 Hz,3H)。
HRMS(ESI)m/z:C29H21BrF9N3O4[M+H]+计算值726.0572,实测值726.0630。
(3)目标化合物2a~2i的合成
化合物的合成以2a为例,将中间体N-(环丙基甲基)-2-((环丙基甲基)氨基)异烟酰胺(10a,1.22 mmol)、三乙胺(6.11 mmol)、二氯乙烷(5.0 mL)依次加入单口瓶中,在冰浴条件下搅拌0.5 h后缓慢滴加2 -苯基丙二酰氯(1.22 mmol)的二氯乙烷(5.0 mL)溶液,滴加完毕后,升至室温继续反应,TLC监测反应进程。加二氯甲烷(30.0 mL)和水(30.0 mL),萃取,取有机层,无水硫酸钠干燥,加适量硅胶拌样,柱层析后得到目标化合物1a。将中间体10a换成相应中间体即可得到化合物2b~2i。理化性质、1H NMR和HRMS数据如下:
化合物2a:黄色固体,收率36%,熔点>152.1~153.3 ℃;1H NMR(400 MHz,DMSO) δ:9.37(d,J=7.2 Hz,2H),8.18(s,1H),7.81(dd,J=7.2,1.2 Hz,1H),7.68(dd,J=8.4,1.2 Hz,2H),7.31(t,J=7.6 Hz,2H),7.17(t,J=7.6 Hz,1H),4.34(d,J=6.8 Hz,2H),3.27 ~3.21 (m,2H),1.20 ~1.01 (m,2H),0.54 ~0.48(m,6H),0.32~0.27(m,2H)。
HRMS(ESI)m/z:C23H23N3O3[M+H]+计算值390.1739,实测值390.1666。
化合物2b:红色固体,收率41%,熔点160.0~161.3 ℃;1H NMR(400 MHz,DMSO) δ:9.46~9.24(m,2H),8.03(s,1H),7.79(d,J=6.8 Hz,1H),7.68(d,J=7.2 Hz,2H),7.31(t,J=7.2 Hz,2H),7.17(t,J=6.8 Hz,1H),4.49(d,J=6.0 Hz,2H),3.24(s,2H),2.83~2.66(m,1H),2.02~1.79(m,6H),1.09(s,1H),0.50(d,J=7.2 Hz,2H),0.29(s,2H)。
HRMS(ESI)m/z:C24H25N3O3[M+H]+计算值405.1929,实测值405.1880。
化合物2c:红色液体,收率56%;1H NMR(400 MHz,DMSO) δ:9.34(dd,J=13.6,6.4 Hz,2H),8.01(s,1H),7.79(dd,J=7.2,1.2 Hz,1H),7.71~7.66(m,2H),7.31(t,J=7.6 Hz,2H),7.17(t,J=7.6 Hz,1H),4.36(t,J=7.6 Hz,2H),3.28~3.21(m,2H),1.66(dt,J=15.2,7.6 Hz,2H),1.44(dt,J=14.8,7.2 Hz,2H),1.09 (tdd,J =9.6,7.6,2.0 Hz,1H),0.96 (t,J =7.2 Hz,3H),0.54~0.46(m,2H),0.35~0.24(m,2H)。
HRMS(ESI)m/z:C23H25N3O3[M+H]+计算值392.1896,实测值392.1956。
化合物2d:黄色固体,收率39%,熔点107.2~108.1 ℃;1H NMR(400 MHz,DMSO) δ:9.35(d,J=7.2 Hz,1H)9.22(d,J =4.0 Hz,1H),8.13 (s,1H),7.77 (dd,J =7.2,1.2 Hz,1H),
7.69~7.65(m,2H),7.30(d,J=7.6 Hz,2H),7.16(d,J=7.2 Hz,1H),4.32(d,J=6.8 Hz,2H),2.96~2.87(m,1H),1.06(t,J=7.2 Hz,1H),0.81(td,J=7.2,5.2 Hz,2H),0.69~0.64(m,2H),0.51(d,J=6.8 Hz,4H)。HRMS(ESI)m/z:C22H21N3O3[M+H]+计算值376.1616,实测值376.1648。
化合物2e:黄色固体,收率56%,熔点>200 ℃;1H NMR(400 MHz,DMSO) δ:9.33(d,J=7.2 Hz,1H),9.18(d,J=4.0 Hz,1H),7.98(s,1H),7.74(d,J=7.2 Hz,1H),7.67(d,J=7.2 Hz,2H),7.31(t,J=7.6 Hz,2H),7.17(t,J=7.2 Hz,1H),4.48(d,J=7.2 Hz,2H),2.96~2.87 (m,1H),2.74 (dt,J =15.2,7.6 Hz,1H),1.98(td,J=7.6,4.8 Hz,2H),1.84(ddd,J=18.8,15.2,8.8 Hz,4H),0.85~0.77(m,2H),0.69~0.63(m,2H)。
HRMS(ESI)m/z:C23H23N3O3[M+H]+计算值390.1739,实测值390.1666。
化合物2f:黄色固体,收率53%,熔点>200 ℃;1H NMR(400 MHz,DMSO) δ:9.34(d,J=7.2 Hz,1H),9.20(d,J=3.6 Hz,1H),7.97(s,1H),7.71(dd,J=27.6,7.2 Hz,3H),7.31(t,J=7.6 Hz,2H),7.17(t,J=7.2 Hz,1H),4.35(t,J=7.2Hz,2H),2.92 (td,J =7.2,3.6 Hz,1H),1.70 ~1.59 (m,2H),1.42(dd,J=14.8,7.6 Hz,2H),0.95(t,J=7.2 Hz,3H),0.86~0.76(m,2H),0.67(d,J=2.4 Hz,2H)。
HRMS(ESI)m/z:C22H23N3O3[M+H]+计算值378.1739,实测值378.1801。
化合物2g:黄色固体,收率72%,熔点180.0~181.2 ℃;1H NMR(400 MHz,DMSO) δ:9.47(s,1H),9.36(d,J=7.2 Hz,1H),8.17 (s,1H),7.80 (d,J =7.2 Hz,1H),7.70 (d,J =7.2 Hz,2H),7.33(t,J=7.6 Hz,2H),7.19(t,J=7.2 Hz,1H),4.35(d,J=6.8 Hz,2H),1.45 (s,3H),1.28 (dd,J =8.0,5.2 Hz,1H),0.85(t,J=5.6 Hz,2H),0.74(t,J=5.6 Hz,2H),0.54(d,J=6.0 Hz,4H)。
HRMS(ESI)m/z:C23H23N3O3[M+H]+计算值390.1739,实测值390.1805。
化合物2h:黄色固体,收率57%,熔点121.1~122.2 ℃;1H NMR(400 MHz,DMSO) δ:9.43(s,1H),9.34(d,J=7.2 Hz,
1H),8.01 (s,1H),7.78 (d,J =7.2 Hz,1H),7.70 (d,J =8.0 Hz,2H),7.33(t,J=7.6 Hz,2H),7.19(t,J=7.2 Hz,1H),4.50(d,J=6.8 Hz,2H),2.04~1.79(m,7H),1.44(s,3H),0.85(d,J=6.0 Hz,2H),0.73(t,J=5.2 Hz,2H)。
HRMS(ESI)m/z:C24H25N3O3[M+H]+计算值404.1896,实测值404.1776。
化合物2i:黄色固体,收率56%,熔点150.9~151.0 ℃;1H NMR(400 MHz,DMSO) δ:9.44(s,1H),9.35(d,J=7.2 Hz,1H),7.99 (s,1H),7.78 (d,J =7.2 Hz,1H),7.71 (d,J =7.2 Hz,2H),7.33(t,J=7.6 Hz,2H),7.19(t,J=7.2 Hz,1H),4.38(t,J=7.2 Hz,2H),1.75~1.60(m,2H),1.51~1.39(m,5H),0.98(t,J=7.2 Hz,3H),0.84(d,J=4.4 Hz,2H),0.74(s,2H)。
HRMS(ESI)m/z:C23H25N3O3[M+H]+计算值392.1896,实测值392.1800。
1. 试验方法
杀虫活性测试由上海晓明检测技术服务有限公司提供,小菜蛾和黏虫为3龄试虫,采用浸叶法测试;苜蓿蚜为3日龄试虫,朱砂叶螨为成螨,采用浸虫法测试。供试药及处理方法参考文献。
2. 测试结果
该类化合物对小菜蛾、黏虫、朱砂叶螨和苜蓿蚜的杀虫活性测试结果见表1。在测试质量浓度范围内,此类化合物对刺吸式口器害虫朱砂叶螨和苜蓿蚜没有生物活性,部分化合物对咀嚼式口器害虫小菜蛾和黏虫表现出一定活性。
当A部分为分子量较大的芳香胺时,无论是R2部位变换成不同的卤素原子,还是R3部位开环或扩环,对小菜蛾和黏虫均无杀虫活性。但将A部分替换成小分子脂肪(或脂环)胺时,活性则有所提高。例如,在100 mg/L,化合物1a对小菜蛾的致死率为0,但化合物2 h却为80.00%。固定R3部位为环丙甲基,分别变换R4部位为环丙甲基、环丙基、甲基环丙基,其中R4为甲基环丙基时杀虫活性较好。固定R4部位为甲基环丙基时,发现R3部位为环丙甲基时杀虫活性最好,但扩环为环丁甲基时活性有所下降,开环为正丁基时活性基本消失。值得注意的是,化合物2a和2g在100 mg/L时对黏虫致死率为100%,且对小菜蛾致死率能达到80%及以上。
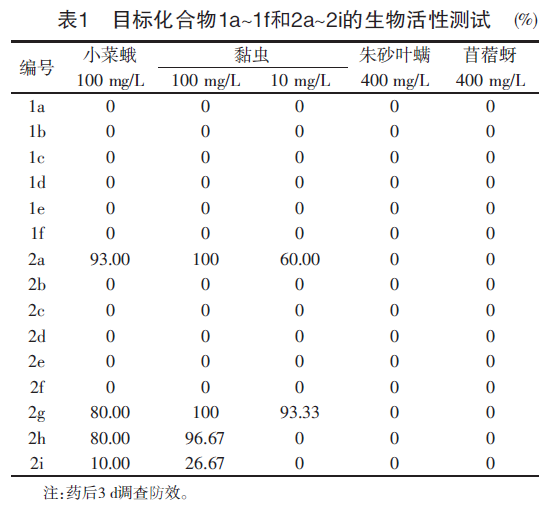
采用活性亚结构拼接法将介离子结构引入间二酰胺化合物中,设计合成了15个结构新颖的化合物,通过1H NMR和HRMS确定其结构,并进行了生物活性测试。
结果表明,此类化合物对刺吸式口器害虫朱砂叶螨和苜蓿蚜没有生物活性,部分化合物对咀嚼式口器害虫小菜蛾和黏虫具有一定生物活性,尤其是化合物2a和2g在100mg/L时对黏虫的致死率为100%,化合物2g在10mg/L对黏虫防效为93.33%;化合物2a、2g和2h在100mg/L时对小菜蛾的致死率≥80%。虽然该类化合物活性不太理想,但其结构新颖,仍然值得进一步研究。