2025年3月18日,仲恺农业工程学院邵明伟、苗爽、喻国辉团队和中国科学院亚热带农业研究所亚热带农业过程与生态过程重点实验室徐智敏等在iMetaOmics在线发表了题为“Modulation of RhizosPhere Microbiota by Bacillus subtilis R31 Enhances Long-Term Suppression of Banana Fusarium Wilt”的文章。

利用B. subtilisR31诱导形成专化型抑病土壤,可以实现抑病土壤类型之间的转换。R31增强了链霉菌与根际核心属之间的联系,同时削弱了伯克霍尔德菌与功能途径膜运输及能量代谢的联系。此外,R31能够诱导潜在的生防细菌向植物根部生长。土壤微生物的拮抗活性与其菌株的产酶活性密切相关,而与其系统发育距离关系不明显。综上所述,作为一项重要的农艺措施,R31的应用诱导形成的抑病土壤与自然形成的普通型抑病土壤在根际细菌群落的次级演替上具有趋同性。
第一作者:邵明伟
通讯作者:喻国辉(ygh76411@zhku.edu.cn)、徐智敏(zhiminxusoil@isa.ac.cn)、苗爽(miao2008shuang@163.com)
合作作者:陈皓君,黄艾芹,郑丽,李春季,秦迪,孙昀皓,林铮,付岗,陈燕红,黎永健,董章勇,程萍,HeruPramono,Kevin D. Hyde
主要单位:仲恺农业工程学院农业与生物学院/华南果蔬绿色防控重点实验室、广西农作物病虫害生物学重点实验室/中国南方水果蔬菜绿色防控重点实验室、中国科学院亚热带农业研究所亚热带农业过程与生态过程重点实验室、泰国真菌研究卓越中心、中国珠海市珠海现代农业发展中心、印度尼西亚Airlangga大学渔业与海洋学院
亮点
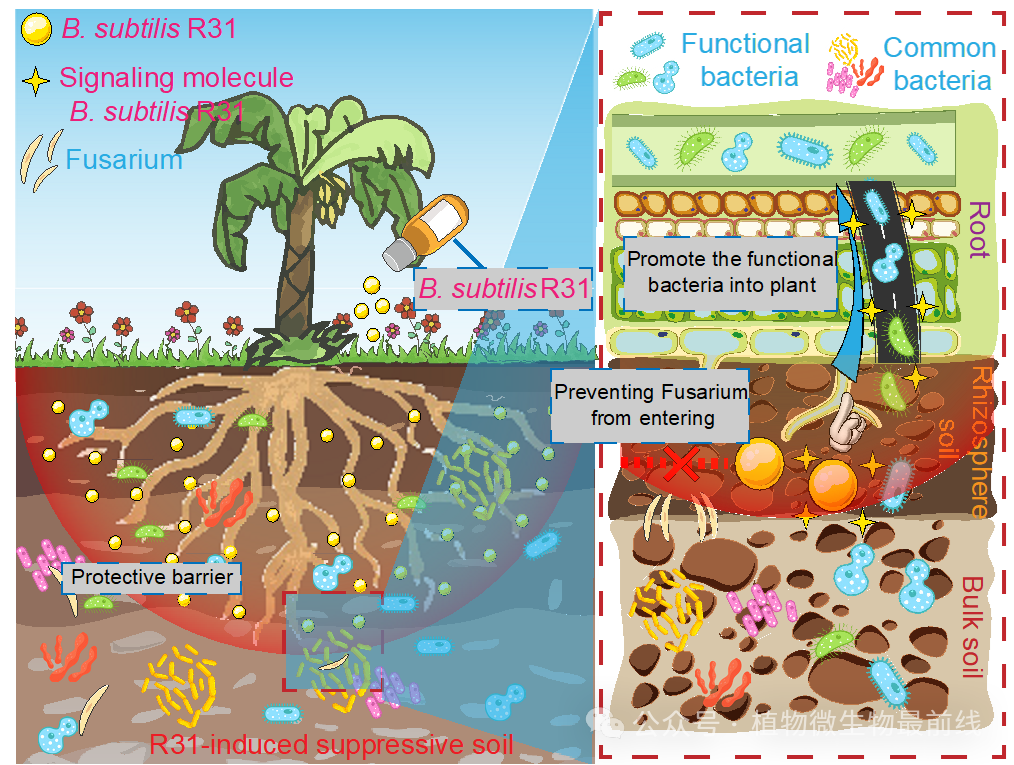
·B. subtilis R31对根际的调节作用即使在消失后仍然存在,增强了对病原菌的抗性。
·生防菌R31调节与抑制病原菌相关的根际核心微生物属和功能途径。
·R31通过调整根际微生物群落有效的控制了香蕉枯萎病,特别是增加放线菌的丰度。
·根部内生细菌对枯萎病菌具有更强的防治效果,强调了菌株相互作用对生物防治的重要性。
摘要
香蕉在长期的连作和重茬种植过程中会导致枯萎病的爆发,损害作物健康,长期的实践结果表明采用生防细菌调节根际微生物群落可能有效遏制这一病害。本研究首次揭示了连续种植超过5年的香蕉田中根际微生物群落的次级演替特征,并评估了生防菌株枯草芽胞杆菌R31(Bacillus subtilis)所诱导的抑制效果。通过高通量测序技术,我们观察到在天然抑病型土壤和R31处理后形成的抑病土壤中,核心细菌属伯克霍尔德菌-迪耶拉菌(Burkholderia-Dyella)和阿瑟罗特菌-拉尔斯托尼亚菌(Arthrobacter-Ralstonia)的富集情况趋势一致,这表明R31诱导了广泛的病原菌抑病型土壤特性。R31显著增强了链霉菌(Streptomyces)与根际核心群落之间的互作,同时减弱了伯克霍尔德菌(Burkholderia)与膜运输和能量代谢途径的关联;此外,它加强了根瘤菌(Rhizobium)与萜类和聚酮代谢之间的正相关关系(r = 0.65,P< 0.01)。可培养试验显示,在46株来自根部和根际的分离物中,具有高IAA、蛋白酶、纤维素酶、几丁质酶、β-1,3-葡聚糖酶活性的菌株均对枯萎病菌表现出显著的拮抗作用。尽管R31在第二年根际中未被检测到,但其对根际功能的调节作用持续存在,表现出与优先效应理论一致的“群体效应”,即早期定殖的有益菌群能够抵抗随后的病原菌入侵。R31诱导了新生香蕉根毛组织中的功能性细菌定殖,建立了新的微生物组模式,有助于长期防控病害。盆栽实验进一步表明,生防菌R31处理后的植株,分布在根内的内生细菌比根际分离菌株对枯萎病的防控效果更好。然而,单菌株处理会导致鞘腐病交叉感染,这表明多种菌株的协同作用可能能够更有效地防控枯萎病。本研究突出了R31在可持续调节根际微生物组、增强酶活性和促进有益细菌定殖方面的潜力,为构建高效的合成菌群以实现更有效的生物防控提供了理论基础。
引言
土壤微生物对植物健康有益,类似于益生菌对人类健康的作用。它们帮助植物抵抗病原菌。连续种植单一作物会导致土壤退化和病害易感性增加。微生物群落结构不平衡会降低土壤抑制有害微生物的能力。然而,据报道某些土壤具有天然的抗菌作用,称之为抑病土,其中有益微生物如Proteobacteria、Firmicutes和Actinobacteria,能增强植物对病原菌的抵抗力。抑病性土壤分为普通型和专化型,后者通常可通过农艺措施形成,两者都是土壤免疫性的重要表现。
目前农业生产上面临的问题如土壤退化和土壤微生物多样性减少,大多是由于化肥使用量不当或连续过度种植引起,这增加了作物对疾病的易感性,如香蕉种植过程中枯萎病的发生。由Fusarium oxysporumf. sp. cubense引起的香蕉枯萎病,是世界香蕉种植中的毁灭性病害。它主要影响香蕉植株的维管束,导致植株凋萎,最终死亡,造成巨大的经济损失。目前香蕉枯萎病缺乏有效的化学治疗方法,因此生物防控成为重要的一种替代方案。有益的植物根部微生物能产生抗病物质,增强植物抗病性,加强和稳定农作生产,提升农业生态系统的稳定性。这些抑病土壤中的微生物能与土壤中的土著病原菌竞争营养及在宿主植物上的侵染位点和生态位。农业上常用的生防菌剂如芽胞杆菌属因其能抑制植物病原菌和促进植物生长,已被广泛研究与使用。经过长期实践我们发现,枯草芽胞杆菌R31在控制香蕉枯萎病方面显示出较强的潜力。
香蕉种植中,连续单一种植模式会导致土壤微生物群落失衡,加剧了香蕉对于病原菌的易感性。实践表明施用生防细菌B. subtilisR31可缓解这些症状,并形成诱导抗性土壤,有利于香蕉种植。根际微生物群落“扩增-选择”模型指出,微生物依次在土体土、根表土和根内逐步被筛选,形成植物根际特异的微生物群落。我们提出施用生防细菌作为一种有效的农艺措施,能够有效的促进功能细菌转移至根际或根内部,可以形成诱导抑病型土壤。本研究旨在探讨B. subtilis R31是如何通调节香蕉根际土壤微生物群落,并增强土壤抗病性。B. subtilisR31已由广东植物龙生物技术有限公司开发成“鼎微”系列产品,该产品已在香蕉产区广泛推广,有效的防控了香蕉枯萎病,产生了较大的社会经济效益。我们调查了跨度为两年的,使用R31对香蕉根际土壤微生物群落次级演替的影响,并检测了可培养细菌的产酶活性、亲缘辨识能力和不同处理条件下香蕉根部土体土、根表土以及根内分离细菌的体外拮抗作用及盆栽活性,阐明B. subtilis R31诱导植物形成健康的内生细菌群落的机制。
结果
R31诱导香蕉根际微生物多样性变化
为了探究连续种植香蕉超过5年的土壤与经生防细菌处理的土壤中细菌群落的差异及其相关性,我们进行了16S rDNA扩增子测序,观察了2019年和2020年B. subtilis R31处理组与对照组样本根际细菌群落的变化情况。测序结果显示,每个样本平均产生了109,256个有效片段(范围介于93,746至120,295之间)(图S1,表S1和S2)。这些有效片段被聚类为7036个操作分类单元(OTUs),每个样本平均含有2,331个OTUs(图S2和表S3至S6)。基于这些OTUs,我们评估了微生物组α多样性,包括丰富度(richness)、香农指数(Shannon)和辛普森指数(Simpson)(图S3和S4,表S7和S8)。2019年和2020年的数据显示,R31处理组与对照组之间的α多样性无显著差异(Tukey多重范围检验,P> 0.05;图1A、B)。通过基于OTUs相对丰度的主坐标分析(PCoA)和非线性模型(NMDS),我们分析了微生物群落间的组成差异(图1C,D)。两个主要坐标轴解释了46%的变异。相似性分析(ANOSIM)和主成分分析(PCA)表明,R31处理组与对照组之间以及不同年份之间的样本分布无显著差异(PERMANOVA检验,R = 0.022,P = 0.426;图1E,F)。值得注意的是,在自然抑病土壤和R31诱导的抑病土壤中,根际细菌群落出现了趋同的次级演替现象。通过对比OTU与SILVA数据库(https://www.arb-silva.de/),我们获取了分类学分类信息。值得注意的是,未发现任何属于R31的OTU,这暗示在应用一年后,R31已从香蕉根际中消失(图1G–J)。在2019-CK、2020-CK和2019-T组中,变形菌门是最丰富的门类,其相对丰度超过30%(图1I-J)。而在2020年R31处理组中,放线菌门(Actinobacteria)的相对丰度(37.5%)超过了变形菌门(Proteobacteria)(25.0%)。在属水平上,链霉菌属(Streptacidiphilus)在所有样本中占据主导地位(图1H)。特别值得注意的是,2020-T组样本中链霉菌属(Streptacidiphilus)、伯克霍尔德菌属(Burkholderia)和链霉菌属(Streptomyce)的相对丰度高于其他组(表S9和S10)。
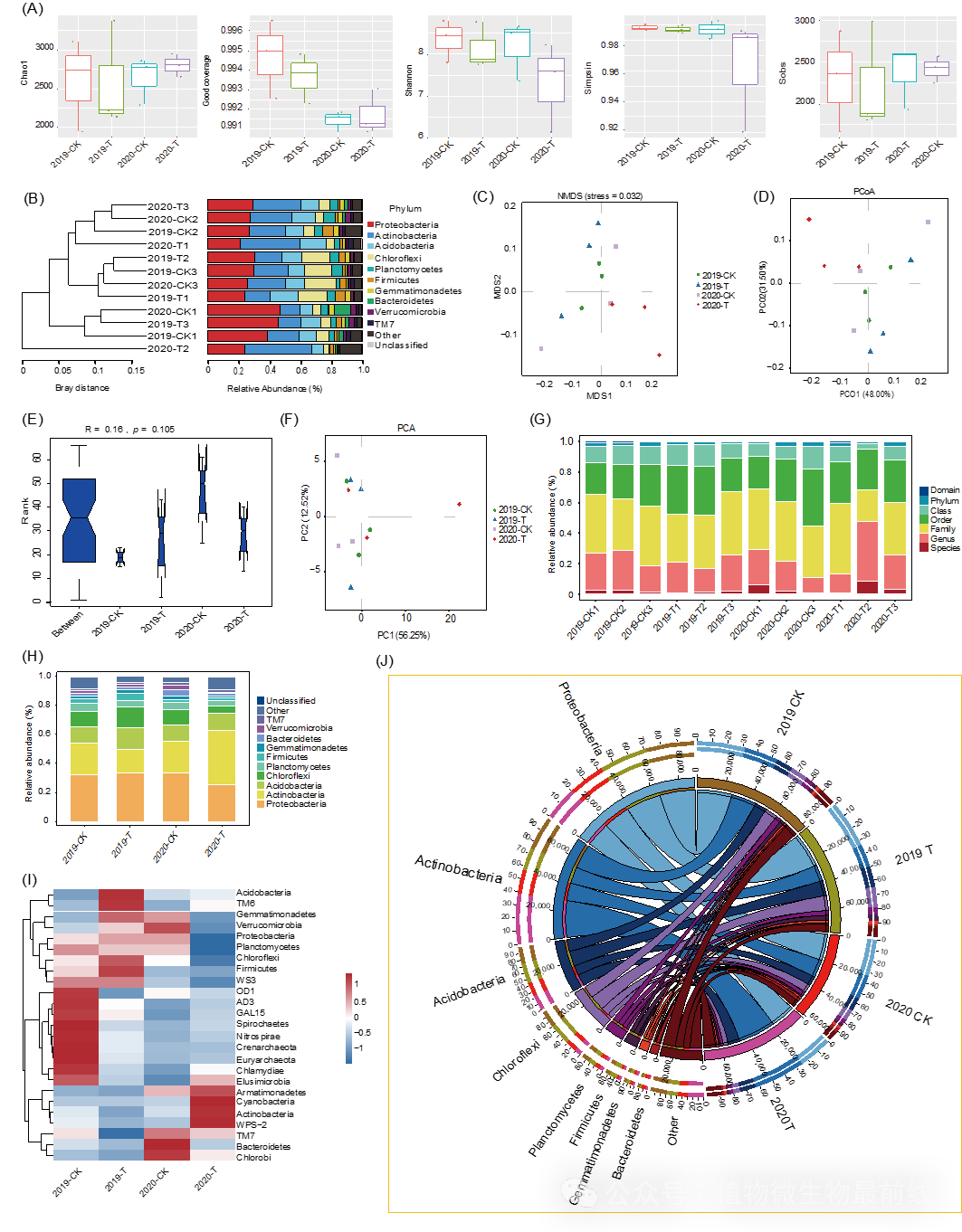
图1 香蕉根际微生物群落多样性
(A)α多样性通过多个指数测量,包括丰富度、Chao1、Good coverage、Shannon、SimPson和Sobs。无显著差异用相同字母表示(P> 0.05,非参数检验)。(B)β多样性通过Bray-Curtis距离和UPGMA聚类图展示。(C)NMDS散点图显示样本间β多样性。(D)β多样性通过PCoA图展示。(E)ANOSIM用于测试不同组间统计显著性。(F)PCA分析β多样性指标。(G)样本在门分类水平上的序列构成条形图。(H)门水平物种分布堆叠图。(I)门以下分类水平物种分类热图。(K)分组门分类水平Circos图,展示物种与样本/组关系。
R31诱导的香蕉根际细菌群落中共现网络
鉴于2019年与2020年间细菌群落的组成存在差异,本研究对R31处理组与对照组的核心属(即在所有样本中均存在的属)进行了比较。结果显示,对照组中识别出76个核心属,而R31处理组中则有71个,两组共有61个核心属相同(图S5和S6)。特别值得注意的是,六个共享的核心属(包括Arthrobacter、Bacillus、Burkholderia、Enterobacter、Rhizobium和Sinomonas)中包含了一些已被实验验证具有生防功能的物种。尽管如此,这六个属在2019年与2020年间的相对丰度均未出现显著变化,唯一的例外是对照组中的芽胞杆菌属,其相对丰度在2020年显著高于2019年(图2A、B)。
本研究构建了生防菌属与其他细菌菌属间的相互作用网络,设定显著相互作用阈值为绝对R值>0.8,P值<0.05。核心生防菌属与对照组31个细菌菌属间观察到显著相互作用,其中19个为对照组核心菌属。R31处理组中32个细菌菌属(含26个共核心菌属)与核心生防细菌菌属显著相互作用。核心生防菌属中,Bacillus、Arthrobacter、Rhizobium和Burkholderia在两组中均显示共现关系。Burkholderia-Dyella和Arthrobacter-Ralstonia共现,Arthrobacter与Acidocella互斥。Enterobacter和Sinomonas相互作用网络在两组间存在显著差异,Sinomonas在R31组中显示间接共现,肠杆菌属与多个菌属互斥,形成不同相互作用网络。
抑制和诱导土壤的群落演替
微生物群落的一个显著特征是其动态性,因为群落通常处于持续的变化和发展之中。于2019年,通过应用R31处理后,研究了2019年至2020年间受抑制和R31处理土壤中的群落演替过程。与2019-CK组相比,2019-T组中Proteobacteria的相对丰度显著更高,该组拥有最多的OTU数量(八个)(图2B和3A–C)。Chlamydiae, Chloroflexi, WPS-2, Armatimonadetes等其他门类仅有1个OTU,且丰度显著较低,其余OTU在丰度上没有显著差异(图3A和表S13)。与2019-CK组相比,2020-CK组中变形菌门的OTU丰度显著降低,而2019-T组则有更多10个OTU。Chloroflexi, GAL15, Planctomycetes, NitrosPirae, Crenarchaeota, 和 Chlamydiae 仅显示出显著较低的OTU数量。值得注意的是,土壤中丰度差异较大的大多数OTU在2020-CK组中相比2019-CK组显示出显著下降的趋势(图3B、C,表S14和S15)。与2019-T组相比,2020-T组中 NitrosPirae, Actinobacteria, Bacteroidetes, TM7, Acidobacteria, Verrucomicrobia, 和Cyanobacteria的OTU数量显著增加。放线菌门的OTU数量显著增高,其中Actinobacteria的数量最多(9个OTU),其次是Actinobacteria(8个OTU)。对于Proteobacteria,显著增加的OTU数量为11个,显著减少的OTU数量为3个,这是具有显著差异丰度的OTU数量最多的(图3D和表S16–S18)。与2020-CK组相比,2020-T组中只有一个Actinobacteria的OTU在丰度上有显著差异,且该OTU的丰度更高。Bacteroidetes, Chloroflexi, Acidobacteria, 和 WPS-2中的差异丰度OTU均显示出显著上升的趋势。Proteobacteria具有最多的差异丰度OTU,共有5个OTUs,其中三个显著更高,两个显著更低。
综合来看,在抑制性土壤的次生演替过程中,Proteobacteria 的OTU数量显著减少。在R31处理的土壤次生演替中,由Actinobacteria差异丰度显著上调的OTU数量最多为九个,其次是Acidobacteria,有八个OTU。R31生防细菌的使用影响了土壤微生物群落结构的演替,这在放线菌门微生物群落中OTU显著增加有所体现。有趣的是,据报道健康根际土壤中的Actinobacteria和Firmicutes的丰度远远高于发病根际土壤。

图2 基于16S rDNA测序的不同组群中核心生物防治属的群落演替
(A)核心生物防治细菌Arthrobacter、Bacillus、Burkholderia、Enterobacter、Rhizobium和Sinomonas的相对丰度。NS,无显著差异;P < 0.05(非参数检验)。(B)健康土壤和R31处理土壤中的群落结构。(C)为核心生物防治属和显著相互作用属构建的微生物相互作用网络。对照样本和R31处理样本中的相互作用。圆圈代表细菌分类群,圆圈的大小代表它们的丰度。线条的粗细代表相互作用关联的强度。
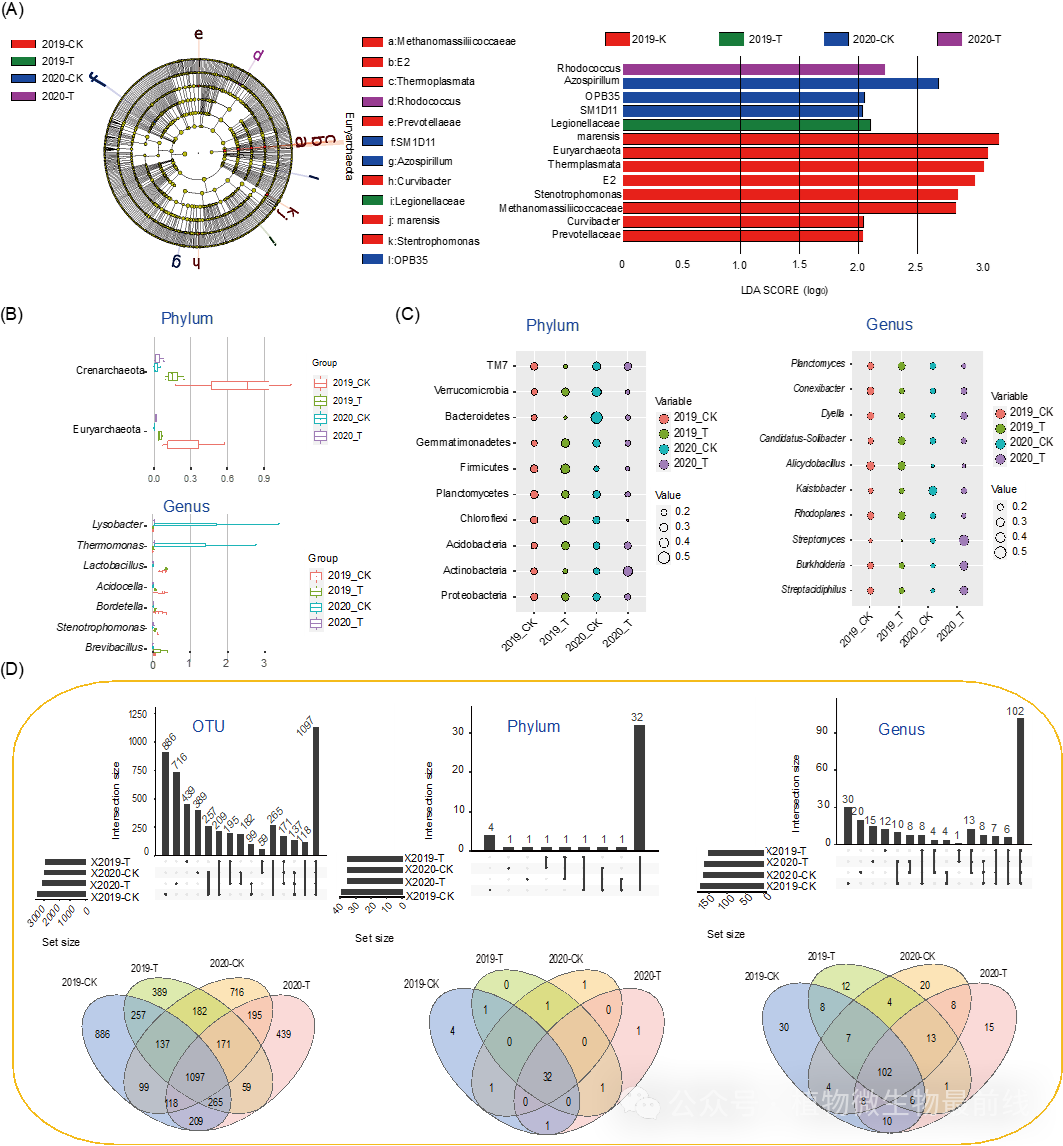
图3 对照组和B. subtilis R31处理组的根际土壤细菌群落演替
(A)LEfSe分析揭示不同处理下的细菌生物标志物。不同颜色和圆圈代表不同处理和分类级别。显著差异的分类群用颜色编码,相对丰度低于0.1%且P< 0.05和log LDA分数大于3.5的属未包括。(B)对照组与R31处理组主要细菌(属水平)存在显著差异,使用P< 0.05(或0.01)作为阈值。垂直轴显示不同门和物种,水平轴显示丰度差异,误差条表示95%置信区间。(C)对照组与R31处理组基于Bray-Curtis指数的指示分析。气泡图显示物种和组别,气泡大小表示指示值,颜色表示分组。(D)对照组与R31处理组群落演替的Venn图和uPset图分析。Venn图中圆圈代表组别,重叠部分表示共同OTU、门或属,非重叠部分表示独特OTU、门或属。
与生防细菌有关的群落的功能特性
利用软件“PICRUSt2”,即“通过重建未观察状态进行群落系统发育研究”,我们深入研究了细菌群落的功能特性。接着,我们基于斯皮尔曼相关系数评估了核心生防菌属及其相互作用菌属对代谢途径丰度的贡献。研究结果表明,在对照组中,伯克霍尔德菌与膜运输和能量代谢途径之间存在显著且正向的相关性(P< 0.05;图S8A,B)。R31处理组也呈现出相似的模式,尽管未达到统计学上的显著性(图S6-S9和表S19-S22)。在两组实验中,伯克霍尔德菌与折叠、分类和降解途径均表现出显著但负向的相关性。在R31处理组中,根瘤菌与萜类和聚酮代谢途径表现出显著且正向的相关性,而与糖类生物合成/代谢和环境适应途径则表现出显著负向的相关性。对照组也显示出类似趋势,但未达到显著水平。Sinomonas在对照组中存在与多种途径显著相关,而R31处理组则没有类似的相关性,芽胞杆菌和肠杆菌在两组实验与各种生物途径均未表现出显著相关性。在与其他核心生防细菌菌属相互作用的属中,念珠菌属和科里杆菌属与萜类和聚酮化合物的代谢以及外源物质的降解显示出显著正相关,而与糖类生物合成和代谢途径则表现出显著负相关(图S8)。
来自不同生境分离菌株的产酶活性和代谢物情况及其体外拮抗活性
总体而言,天然形成的抑病土壤与R31诱导的抑病土壤中的核心菌属趋于一致。依据根际微生物组的“扩增-选择”组装模型和“群体效应”概念,微生物在土壤、根际和内部根系中逐渐被选择,形成植物根际特有的微生物群落。基于Greengenes数据库,我们利用Bugbase进行群落的表型预测。通过整合IMG、KEGG和PATRIC数据库的基因信息,它们被分为7个主要类型,包括革兰氏阳性、革兰氏阴性、生物膜形成、致病性、含有移动元素、氧气利用(包括好氧型:好氧,厌氧型:厌氧,兼性厌氧型:兼性厌氧)和氧化应激耐受(氧化应激耐受)。我们注意到,在抑制土壤和R31诱导的土壤中,表型预测和表型贡献相似(图S4A和S10-S11,表S23-S25)。为了揭示在天然抑病土壤、根际和内部根系中微生物群落定殖的规律性,我们从天然抑病土壤和R31诱导的抑病土壤中,共获得了46株细菌分离菌株,这些分离菌株来自六个微环境:健康香蕉植物根部的外侧和内侧(分别为SR和SE);用R31处理过的香蕉植物根部的外侧和内侧(分别为HR和HE);健康香蕉植物周围的土体土和用R31处理过的香蕉植物周围的土体土(分别为SS和HS)(图4B和表S26)。从HR(九个)、HE(七个)和HS(七个)中获得的分离物数量分别与SR(四个)、SE(九个)和SS(十个)相当(图4C)。在这六个微环境中,SE和HR的细菌数量密度最高和最低(分别为128.3×104cfus /g和46.7×104 cfus/g)。我们对46株细菌分离株进行了16S rDNA基因测序。16S rDNA基因测序结果形成了16个簇(图4C、D)。产酶活性测试结果表明在46株分离株中,34株(73.9%)产生蛋白酶,5株(10.9%)产生几丁质酶,38株(82.6%)产生纤维素酶,22株(47.8%)产生β-1,3-葡聚糖酶,45株(97.8%)产生生长素分子吲哚-3-乙酸(IAA)(图S12-S15和表S27 )。
研究发现分离的微生物拮抗作用与芽胞杆菌属的系统发育距离倾向于正相关。同时我们分析了46个分离细菌的酶活性、拮抗作用和系统发育距离之间的关联性(图5)。结果表明大多数菌株在系统发育树上显示出较强的产蛋白酶活性,特别是HE1(Streptomyces chrysomallus)和HE3(B. velezensis)菌株。HE1菌株β-葡萄糖苷酶活性高,但与其他菌株系统发育距离较远。SR50菌株(Lysobacter enzymogenes)在四种酶中表现出良好的酶活性,尤其是纤维素酶,并对FOC004和FOC009有较好的拮抗作用。从上述结果来看,与R31系统发育距离近的菌株一般表现出较强的产蛋白酶活性,而产几丁质酶活性弱,产纤维素酶产量较为平均。从根部土体土中的分离菌株几丁质酶活性普遍弱,纤维素酶活性中等。SE16、SE17、SS31、SS32、SE15、SS23和SR46菌株表现出较弱的酶活性同时也表现出较弱的拮抗活性。基于以上结果我们初步得出结论,从植物的根部土壤及组织内部分离的菌株,其拮抗活性与酶生产能力可能更加相关,强于与系统发育距离的关系。
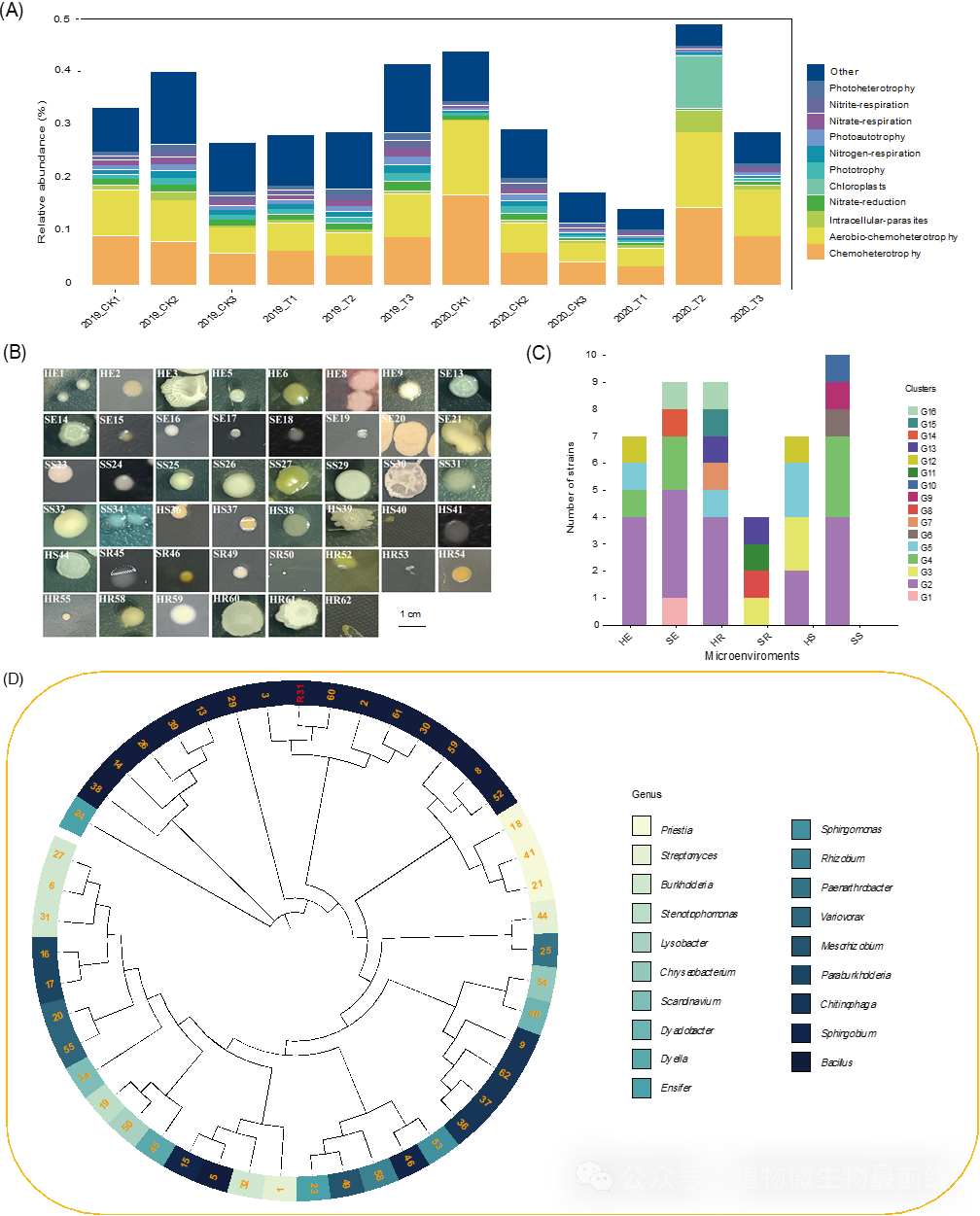
图4 土壤中分离出的R31和46菌株的鉴定及其系统发育关系
(A)显示了对照组和R31处理组FAPROTAX功能分类的相对丰度堆叠图,不同样本在水平轴上,不同颜色的柱状图表示不同生态功能的相对丰度。(B)展示了健康香蕉植株和用R31处理的香蕉植株六个微环境中细菌分离物的单菌落形态。(C)对46个细菌分离物进行了ARDRA和16S rDNA基因测序,产生了16个簇。(D)使用MAFFT对土壤中分离出的R31和46菌株的序列进行比对,并用邻接法分析确定系统发育关系。
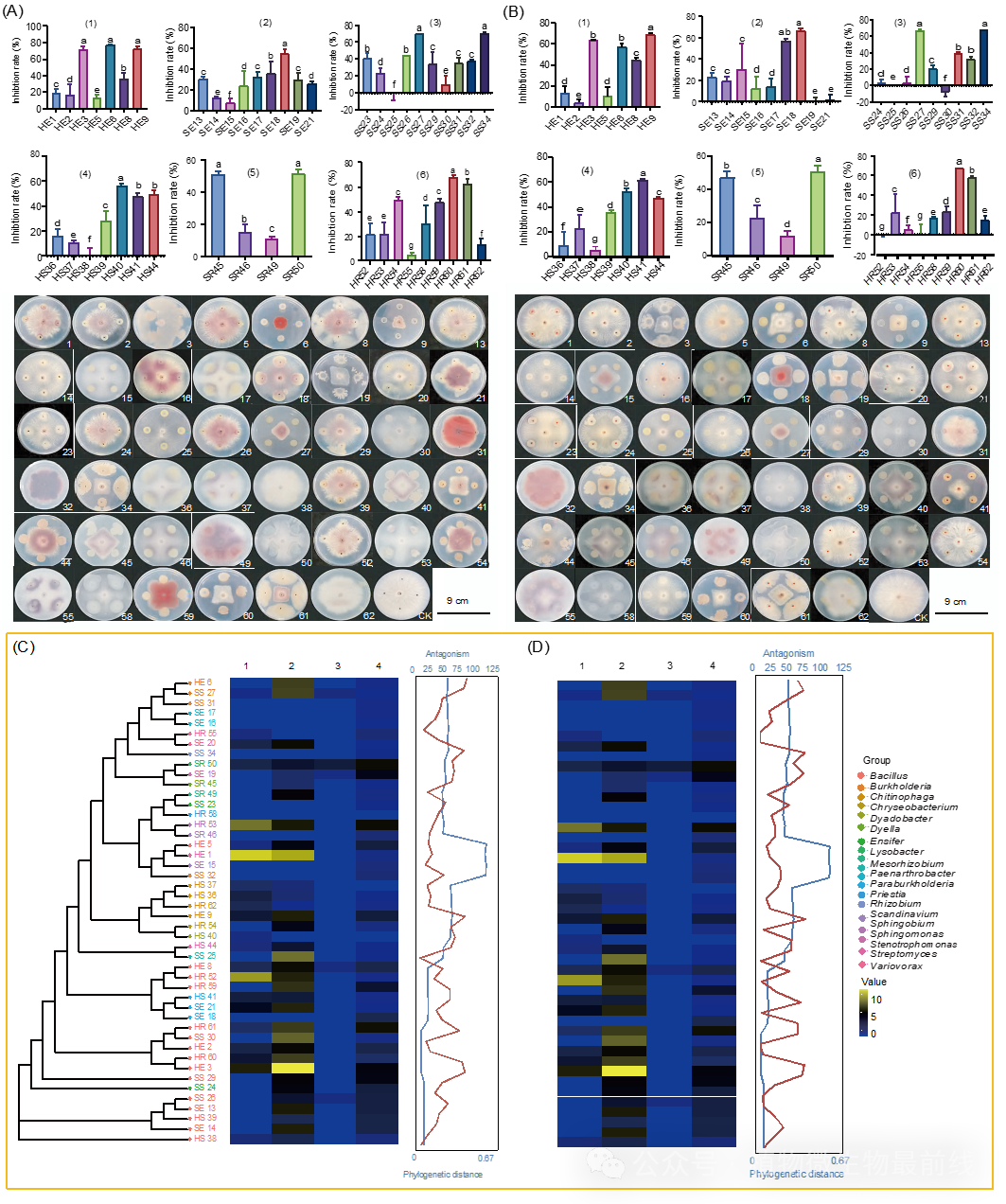
图5 46株细菌分离物的拮抗作用、系统发育距离和酶活性
(A)BACs对FOC 004的抑制率;柱状图(1)-(6)显示不同栖息地中BACs对FOC 004的抑制效果。小写字母表示显著差异(P< 0.05)。数据用SPSS分析,采用LSD和Duncan方法。(B)BACs对FOC 009的抑制率。热图左侧邻接树基于46株菌的16S rDNA序列重建,用MAFFT比对。热图展示46株细菌的β-1,3-葡聚糖酶、蛋白酶、几丁质酶和纤维素酶活性。右侧盒中红色曲线表示FOC004和FOC009的拮抗表型,蓝色曲线表示R31与分离菌株的系统发育距离。不同字母表示显著差异(P< 0.05)。
R31与香蕉根际微生物群的亲缘关系
目前已有的报道发现拮抗作用与系统发育距离之间存在着负相关,当然也有类似报道证明枯草芽胞杆菌拮抗作用与系统发育距离之间存在着正相关。亲缘辨识是微生物之间合作的基础,菌落融合与形成边界现象是鉴定细菌亲缘的关键。研究分离菌株之间的亲缘辨识或许能够给出较好的解释。本研究探讨了R31菌株在群游运动、生物被膜形成和拮抗活性中区分亲缘和非亲缘的能力。群游实验中,我们发现4株菌与R31融合,包括HE8、SE18、SE21、和HS38;SE14和SS30两株菌与R31形成半融合;8株菌HE2、HE3、HE5、SE13、SS24、SS26、SS29、和HS39与R31表现出边界现象。晕环生物测定结果显示R31-GFP与13株菌表现出边界现象。生物膜混合实验中,R31-GFP与多种菌株共存,而且不同混合比例下存活情况各异。共培养系统中,部分菌株与R31-GFP共存,其他则不存活。细菌拮抗试验表明,R31对测试菌株的接种距离无显著影响(图6)。

图6在自然健康香蕉根部中B. subtilis R31与内生细菌之间的亲缘关系鉴别
群游实验:采用R31和特定菌株,观察群体运动的形态特征。细菌晕圈实验:利用GFP标记的R31和特定菌株,测量晕圈形态特征,并在Leica激光显微镜下以488/510 nm荧光模式观察。生物膜混合实验:在488 nm荧光模式下,观察R31与特定菌株的生物膜混合情况。实验中,GFP标记的B. subtilis R31与指定菌株以不同比例接种。橙色箭头指示GFP标记的B. subtilis R31,其他颜色箭头指示测试菌株。
香蕉根际土壤中分离菌株的功能分析
我们筛取了9株具有潜力的生物防菌株,这些菌株将被用于接下来的盆栽实验。通过计算不同处理的疾病指数,我们发现HE3、HE9、SE19、HS41和SR50菌株处理的香蕉幼苗症状有显著改善,感染率和疾病指数控制效率均优于对照组。特别是HS41、HE3、HE9、SR50和SE19菌株处理的幼苗在生长和抗病指标上表现突出(表S29,图7A-F)。此外,在进行盆栽实验过程中我们发现,伴随着接种香蕉枯萎病菌的植株在出现枯萎病的同时也会出现香蕉鞘腐病的一些症状,尤其是在接种我们筛选后的潜力细菌菌株,这是我们不得不考虑的一个因素。数据显示,HE6、HS41、SE19、SS27和SR50菌株处理的植株分别有不同程度的香蕉鞘腐病病害交叉感染率,分别为30%、10%、43.3%、30%与3.33%(表S29)。综合以上数据表明,来自生防菌R31处理后的香蕉根部内生菌HE3和HE9潜力大于土体土来源的HS41,未经处理的健康土壤中来源于根表土SR50菌株优势明显大于根内SE19。研究结果还显示,R31诱导的土壤细菌在控制效果上优于天然抑病土壤来源的细菌。根系内部分离的细菌(R31施用)在综合控制效果上优于根际细菌(R31施用),而从天然抑病土壤中分离的根际细菌在控制效果上优于根系内部细菌(健康土壤)。
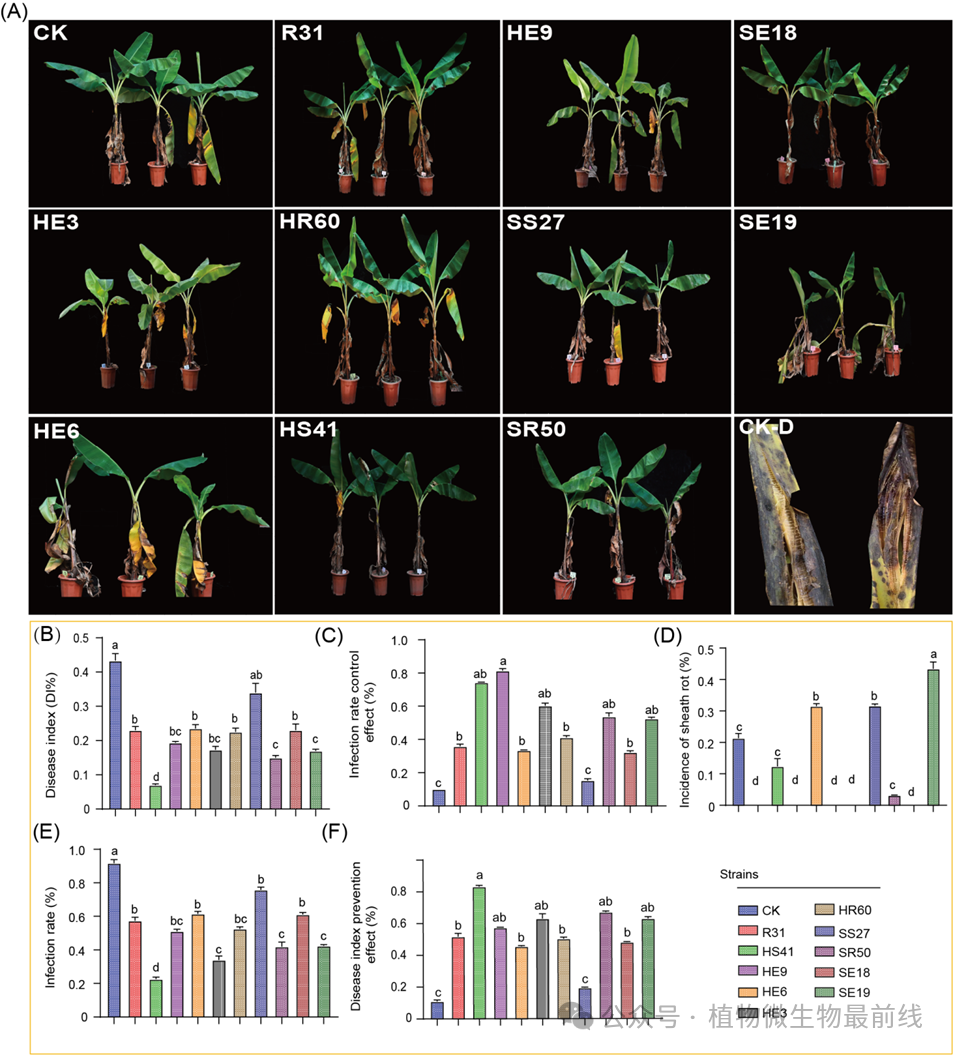
图7:目标菌株对盆栽香蕉植物枯萎病的生物防治效果
(A)盆栽植物图片表示:CK:对照;R31:B. subtilis R31;HS41:Bacterium sp. HS41;HE9:Chitinophaga sp. HE9;HE6:Burkholderia sp. HE6;HE3:B. amyloliquefaciensHE3;HR60:B. amyloliquefaciensHR60;SS27:Burkholderiasp. SS27;SR50:Lysobactersp. SR50;SE18:B. megateriumSE18;SE19:Stenotrophomonas panacihumi SE19;CK-D:解剖后的对照。(B)、(C)、(D)、(E)和(F)条形图表示:测试菌株的病情指数、感染率(%)、病情指数预防效果(%)、感染率控制效果(%)和鞘腐病发生率(%)。误差棒表示直径的平均值±标准差。不同的小写字母表示显著差异(Duncan's多重检验,P< 0.05)。
讨论
根际土壤或根部的微生物群落结构和功能并非静止不变,而是处于一个动态演替的状态,根际微生物群落的组建同时也会受到环境因素的影响。一些研究表明,引入改变微生物群落的菌株会慢慢在土壤中被消除,而其他研究则报告称,施用植物生长促进细菌可以显著提高植物生长发育。这一看似矛盾的现象,表明需要更深入地了解微生物诱导的土壤中微生物分布和演替的机制。在此,我们首次研究了基于连续种植香蕉超过5年以上的健康蕉园土壤以及施用生防细菌R31形成的的抑病土壤,来揭示根际土壤中微生物的次级演替过程。我们观察到,在自然抑病土和R31诱导形成的抑病土壤中,根际环境细菌群落的次级演替过程趋于一致,核心属均为Burkholderia-Dyella和Arthrobacter-Ralstonia。我们证明了使用生防菌诱导形成专化型抑病土与普通抑病型土壤之间可以存在着互相转化。
引起土壤抑病性的微生物可以分为普通型和专化型。在普通抑病型土壤中的有益微生物能够与土壤病害病原菌竞争养分、感染位点或植物定殖位点。据报道普通型抑病土壤不能转换成不同土壤中。对于专化抑病土壤而言,有益微生物产生的抗生素或其他抗菌物质在土壤抑病性中起着重要的作用,同时可转换性是专化抑病土的主要特征。专化抑病土,也称之为诱导型抑病土(诱导形成抑病性),通常可通过某些农艺措施调节形成。在本研究中我们分析了天然形成的普通型抑病土与R31诱导形成的的抑病土壤核心微生物群落、生防菌属丰度、物种相关性、微生物相互作用网络以及关键物种的潜在功能。生防菌株枯草芽胞杆菌R31在一定程度上增强了链霉菌与根际核心菌属的关联性,削弱了伯克霍尔德菌与功能途径膜运输和能量代谢之间的关联。R31显著增强了根瘤菌与萜类和聚酮途径代谢之间的正相关关系,而与糖类生物合成和代谢以及环境适应途径变现出负相关。通过可培养技术我们从自然抑病土和R31诱导形成的抑病土壤的六个微环境中获得并鉴定了46株细菌检测了其产生IAA、蛋白酶、纤维素酶、几丁质酶及β-1,3-葡聚糖酶活性的能力,以及体内外的亲缘鉴定和拮抗作用。结果表明,R31可能通过调节香蕉根际微生物群落结构(特别是增加放线菌的丰度)发挥作用,帮助潜在的生防细菌迁移到植物根内部,以预防和控制香蕉枯萎病。
优先效应理论指出,微生物定殖的顺序可以决定植物宿主抵抗后续病原菌入侵的能力。优先建立的群落更加稳定可靠,更能抵御后来的入侵者,并且在很大程度上不受后来入侵者的干扰。总体而言,R31与佛山三水采集的分离株进行亲缘辨识实验显示,R31和大多数分离株表现出边界现象,在实验中呈现出远缘现象。有趣的是,在第二年的土壤并未检测到R31在根际中存在,这表明其诱导形成的抑病性作用可能是通过最初调节根际微生物群落实现的,即使R31消失后形成的抑病性仍能持续。这突显了R31在诱导形成抑病性中的潜在“遗留效应”。为此我们提出假设,在R31促进香蕉根部根毛生长的过程中,R31通过化学通讯作用诱导一些功能细菌迁移到新生根毛组织,然后进入植物内部形成新的微生物群落结构(图8)。值得注意的是,生防菌R31的消失以及通过优先效应形成的根际微生物组,很可能不是由根际微生物之间相互作用决定的,因此其中涉及的机制仍然然需要更深入的研究。
我们测试发现R31和46株分离细菌的群游行为和生物膜融合能力并不一定与它们的系统发育距离密切相关,但产酶活性能力与分离菌株对枯萎病菌的拮抗活性呈正相关。特别是当这些细菌是从根系内部(天然抑制土壤和R31诱导的抑制土壤)分离时,与从外部分离的细菌相比,这种关系更为明显。细菌间的拮抗活性测试显示,枯草芽胞杆菌R31与这46种测试的细菌分离株之间没有明显的规律关系。这种角色转换有时取决于菌株之间的接触距离,表明挥发性有机化合物和其他可溶性次级代谢物可能参与了这些微生物间的相互作用。我们推测,生防菌株R31与香蕉根际微生物群之间存在复杂的合作关系,包括中立性、共生性、协同性、互惠性、非共生性和竞争性。
盆栽实验结果表明,潜在的目标菌株对由FOC004和FOC009引起的香蕉枯萎病具有较好的控制效果,但没有明显的形式规律。然而,根部的内生细菌在预防和控制枯萎病方面表现出比根际土壤中的细菌更好的效果,尤其是在R31诱导形成抑病土壤中更为明显。但需要注意的是,用单一菌株处理的香蕉植株更可能表现出鞘腐病的交叉感染症状。因此,具有生防功能潜力的菌株更有可能先在植物内部形成稳定的定殖之后才会发挥自身的抗病促生能力。此外,有许多微生物单独使用时不会引起土壤抗病性。为此,我们猜测土壤抑制病原菌并非由单一菌株引起,而更可能是多种微生物协同作用的结果。使用人工合成微生物群来实现生防细菌的抗病和促生长功能目前得到越来越多的关注。然而,关于如何构建这样的合成细菌群落以及如何选择潜在的生防细菌,仍缺乏有效的科学依据。我们的研究揭示,选择胞外酶分泌水平高且具有较强定殖能力的细菌,可能是快速选择潜在生防细菌并构建有益合成细菌菌群的有效策略。当然,R31与其他根际微生物之间相互作用的分子机制,包括挥发性有机化合物和次级代谢物在介导微生物群落动态变化中的作用仍然需要进一步探讨。此外,对于R31诱导的专化型抑病土壤的持久性和转移性仍然需要经过长期的生产实践去证实。
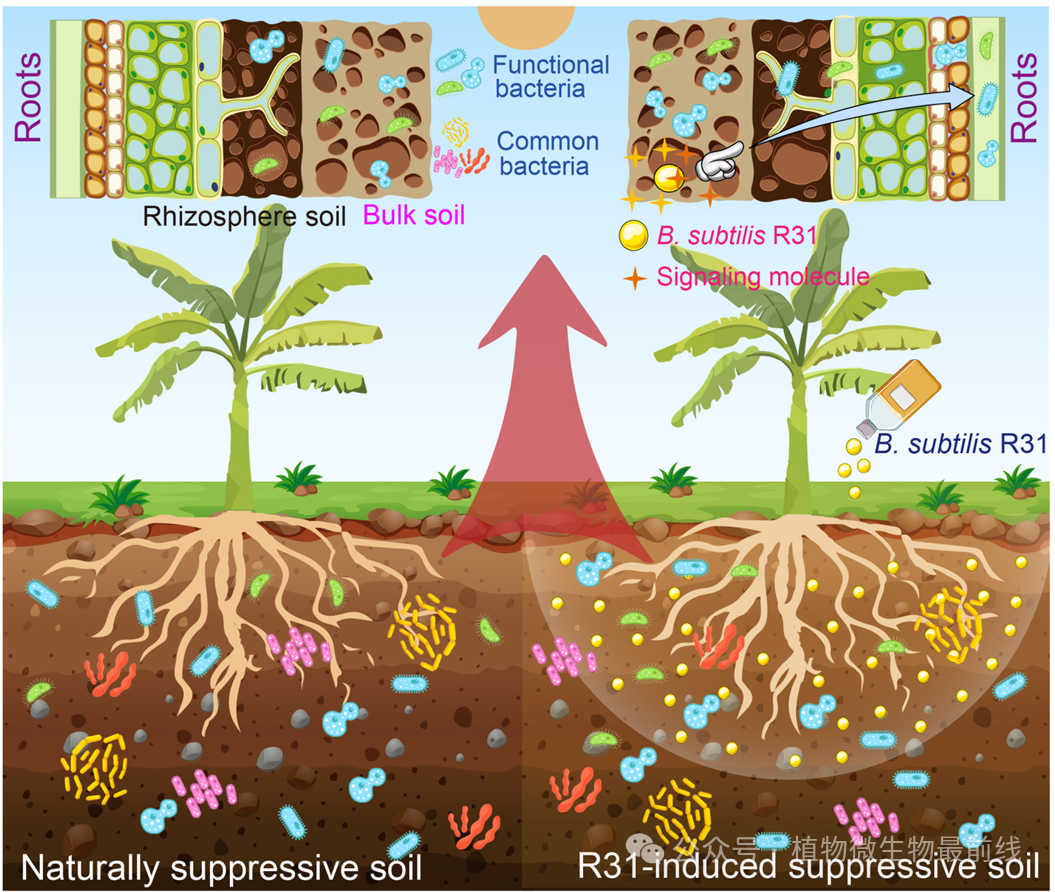
图8:枯草芽孢杆菌R31通过影响定殖香蕉植株的根际菌株来促进枯萎病的防控模式图
枯草芽孢杆菌R31(黄球)调节香蕉根际微生物菌群的结构和功能,防治香蕉枯萎病。在促进香蕉根系根毛生长过程中,R31定殖于根部;R31通过纤维素、几丁质酶和其他可溶性次生代谢物的作用,改变根毛表面的孔径。R31通过化学通讯(金色四角星)诱导功能细菌快速迁移到新生根毛中,促进定殖。
作者简介

邵明伟(第一作者)
• 仲恺农业工程学院特聘副教授,硕士生导师。
• 主要研究方向为:香蕉枯萎病、鞘腐病和软腐病等岭南特色果蔬重大疫病的生物防治技术和产品开发。以第一作者及通讯作者于Journal of Agricultural and Food Chemistry, Journal of Cellular Physiology,Communications Biology, Insect Science等期刊发表SCI论文12篇,主持在研国家自然科学基金青年基金、广东省科技厅乡村振兴—广东省驻镇帮镇扶村科技特派员团队、广州市科技计划项目等10余项,获得珠海市科技进步三等奖1项。
通讯作者简介

苗爽(通讯作者)
• 仲恺农业工程学院助理研究员,硕士生导师。
• 长期从事植物免疫信号转导、植物内生芽胞杆菌生防机制等领域的研究,主攻芽孢杆菌防控香蕉枯萎病、鞘腐病、粉葛腐烂病等机制的研究。主持在研国家自然科学基金青年基金、广东省基础与应用基础研究基金等4项,以第一作者及通讯作者于Journal of Integrative Plant Biology, Journal of Cellular Physiology期刊发表SCI论文2篇。

徐智敏(通讯作者)
• ⽣态学博⼠,中国科学院亚热带农业⽣态研究所副研究员,美国罗格斯⼤学⼟壤系⾼级访问学者,担任⾼影响⼒SCI期刊iMeta(IF2023 23.8)执⾏副主编、Front. Microbiol.客座副主编、Agronomy客座主编、Soil Sci. &Environ科学编辑、Eco-Environ. & Health⻘年编委等学术兼职。
• 主要从事微⽣物⽣态与调控、根际微⽣物互作与元素⽣物地球化学循环等⽅⾯研究。先后主持国家⾃然科学基⾦项⽬、国家重点研发计划⼦课题、⼴东省⾃然科学基⾦⾯上项⽬、⼴东省⾼校重点领域专项等20多项课题。共发表SCI收录论⽂56篇,近5年发表SCI收录论⽂42篇,包括Microbiome、J. Hazard. Mater.、Environ. Int.、Sci. Total. Environ.、Environ. Sci-Nano、Environ. Pollut.等环境领域知名期刊,主编/副主编教材3部,授权国家发明专利5项。获得华夏建设科学技术三等奖1项(省部级)、地理信息科技进步⼆等奖1项(省部级)、⼴东省环境保护科学技术⼀等奖1项、⾦粤⾃然资源科学技术⼆等奖2项、⼴东省环境技术进步⼆等奖3项、全国商业联合会科学技术三等奖1项、⼴东省农业技术推⼴⼆等奖1项。

喻国辉(通讯作者)
• 仲恺农业工程学院农业与生物学院副院长(主持工作),研究员,硕士生导师。
• 研究方向为土传维管束病害绿色防控研究,植物内生生防菌资源筛选与评估、内生菌诱导寄主系统抗性等领域的研究,主攻香蕉枯萎病、鞘腐病和软腐病等岭南特色果蔬重大疫病的生物防治技术和产品开发。主持和参加各类国家、省和市级科技项目20余项,发表学术论文63篇(SCI收录9篇),申请发明专利6项,获得5项发明专利授权,其中3项发明专利实现成果转化。获得省级科技进步奖二等奖和三等奖各1项,珠海市科技进步二等奖和三等奖各1项,农业部丰收奖三等奖1项,广东省推广三等奖1项。