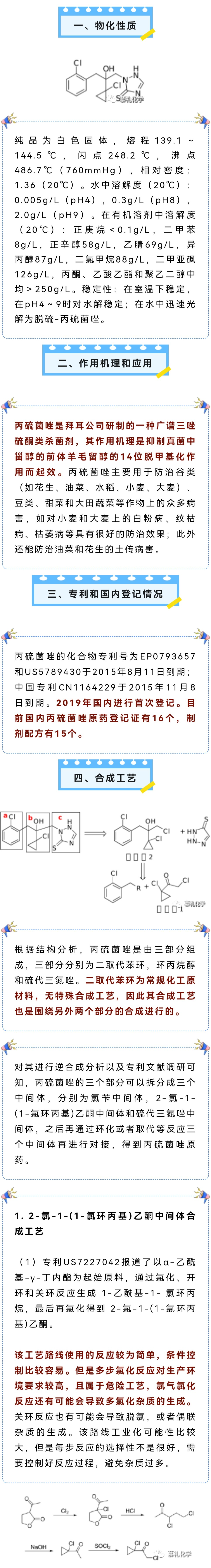
(2)有文章报道以1-羟基-1-甲基环丁烷为原料,在过渡金属催化剂醋酸钯催化下开环得到5-氯-2-戊酮,然后在碱性条件下合环得到1-乙酰基环丙烷,最后用四氯化钛进行氯化反应得到 2-氯-1-(1-氯环丙基)乙酮。该工艺路线相对较短,但是缺点很多。首先用醋酸钯催化过程的金属回收和成本非常难控制;其次使用四氯化钛对操作要求很高,淬灭四氯化钛也是很麻烦;最后一点是原材料成本也很高,也不易得到。此条工艺路线无优化意义,只适合科研。

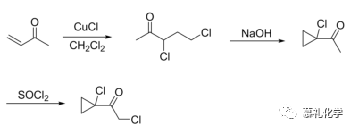
(4)专利US6025528报道了以5-羟基-2-戊酮为起始原料,通过羟基氯化反应得到5-氯-2-戊酮,再在碱性条件下关环得到1-乙酰基环丙烷,最后与第二条工艺路线相同方式,经四氯化钛进行氯化得到2-氯-1-(1-氯环丙基)乙酮。
该路线与第二条工艺路线存在相同问题,四氯化钛的操作和后处理比较麻烦,这里的氯化完全可以考虑用氯气或者其他氯化试剂。该路线可以考虑进行优化后进行工业化。
2. 丙硫菌唑的合成
很多专利报道了丙硫菌唑的合成工艺。
(1)专利US6201128报道了锌试剂合成丙硫菌唑的工艺。用邻氯氯苄合成邻氯苄基氯化锌试剂,然后与1-(1-氯环丙基)乙酰氯反应,得到苄基环丙烷酮的中间体,然后再与三甲基氯化亚砜盐进行Corey-Chaykovsky反应得到环氧结构,随后再与三氮唑进行取代,最后再与硫磺进行硫代得到丙硫菌唑;
(2)专利US4913727报道了以2-氯-1-(1-氯环丙基)乙酮为原料,与三氮唑发生取代反应,再与邻氯氯苄的格式试剂反应制得2-(1-氯环丙基)-3-氯-1-(2-氯苯基)-2-丙醇中间体,最后通过硫磺进行硫代反应得到丙硫菌唑;
(3)有文章报道,以邻氯苯乙酸甲酯和氯代环丙基甲酸酯为原料,通过Claisen缩合反应得到羰基官能团,然后再进行环氧化,最后关环氧化得到丙硫菌唑。
这几种方法都只是适合科研,不适用与工业化生产,主要是效率低,特别是环氧化这步反应效率低、操作要求高,还需要用到强碱,非常不适合工业生产。锌试剂与酰氯反应的操作要求和选择性在工业生产中都存在一定问题。
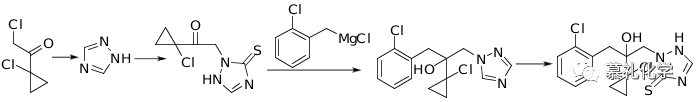

下面介绍以2-氯-1-(1-氯环丙基)乙酮中间体,几种常见或者可以优化后进行工业化生产的工艺路线。
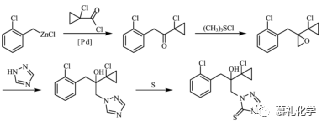
(1)专利US6172236报道了以邻氯氯苄为原料,制备苄基格氏试剂,然后与2-氯-1-(1-氯环丙基)乙酮反应得到四级醇中间体,然后再与三氮唑发生取代反应,最后再用硫磺进行硫代反应得到丙硫菌唑。该工艺路线比较短,每步反应的选择性也是比较好,收率也较高。
但是格氏试剂的制备和格氏反应对操作要求比较高,硫磺硫代反应需要用DMF且高温,溶剂回收也是存在问题。但是这些问题如果进一步优化,该路线还是可以用于工业化生产的。
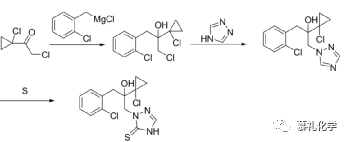
(2)专利US722704报道了与上述类似的工艺路线。
以邻氯氯苄为原料,制备苄基格氏试剂,然后与2-氯-1-(1-氯环丙基)乙酮反应得到四级醇中间体,然后再与水合肼进行取代反应,与甲醛、硫氰酸盐进行关环,最后再氧化芳构化得到丙硫菌唑。
该路线的优势是避免了上述路线使用DMF高温之别硫代三氮唑的问题,但是还是用到格氏试剂和格氏反应,对生产操作要求还是有一定难度,而且比上一步多了一个氧化反应,目前使用的氧化剂一般为氯化铁,该氧化剂的后处理和回收也是需要进一步的进行工艺优化,或者更换其他更加有效的氧化剂。

最后两个合成工艺相对比较靠谱,但是由于是专利报道的,我们也根据其进行了优化,可以得到更加合适的工艺路线,解决上述可能存在的问题。