害虫抗药性的发生发展和高风险杀虫剂的相继限用禁用致使市场上实际可用杀虫剂减少。作为源自蜘蛛毒肽的新型生物杀虫剂,GS-ω/κ-HXTX-Hv1a有望为持续有效的害虫治理提供新工具,其成功开发和应用有力证实了多肽可直接作为农药进行商业化。
GS-ω/κ-HXTX-Hv1a具有经济实用的生产成本、独特的抑制剂胱氨酸结基序、协同的双重作用机制、全新的作用靶标位点、广谱的生物活性以及优异的安全性等特点,兼具化学杀虫剂的有效性和生物制品的低风险性,在害虫绿色防控、昆虫病原体改良、转基因作物开发和新农药创制等方面的应用前景广阔。
从研发背景、通用名、序列结构、作用机制、生物活性、安全性和应用前景等方面对GS-ω/κ-HXTX-Hv1a研究开发与应用的进展情况进行总结,为GS-ω/κ-HXTX-Hv1a及同类蜘蛛毒肽品种在害虫防控上的研究、开发和应用提供参考和支持。
世界人口快速增长给粮食供应和分配带来巨大挑战。由于可耕种土地面积有限,粮食生产增加主要通过提高作物产量来实现,因此有效的害虫治理显得尤为重要。而蚊虫等病媒害虫的防控还可有效阻断由其介导的疟疾、丝虫病、登革热和黄热病等疾病传播。
虽然生物防治、物理防治、农业管理和植物检疫等措施越来越常见,但化学防治仍旧是农业和公共卫生领域害虫防治最有效的方法。由于化学杀虫剂作用的分子靶标相对有限,其大量频繁、不科学的使用使多种害虫的抗药性不断出现和发展。随着公众对安全健康和环境生态的愈发关注,不少高风险化学杀虫剂在世界范围内先后被限用或禁用。加上新型杀虫剂研发上市的成本增加、周期延长、难度加大,市场上实际可用的杀虫剂有所减少。近年来,以天然产物为来源开发高效低风险杀虫剂得到广泛关注和快速发展。
放线菌分泌物阿维菌素和多杀菌素,活体微生物苏云金芽孢杆菌和杆状病毒,植物提取物土荆芥提取物和楝油,以及源自天然蜘蛛毒肽的GS-ω/κ-HXTX-Hv1a 等天然源杀虫剂都得以成功开发和应用。其中,新上市的多肽杀虫剂GS-ω/κ-HXTX-Hv1a整合了化学杀虫剂的有效性和生物制品的低风险性,有望为农业和公共卫生领域害虫防控提供一种持续有效的绿色新工具。目前尚未见有关该新型生物杀虫剂的系统报道。本文从研发背景、通用名、序列结构、作用机制、生物活性、安全性和应用前景等方面对GS-ω/κ-HXTX-Hv1a的研究、开发和应用的进展情况进行总结,以期为GS-ω/κ-HXTX-Hv1a及同类蜘蛛毒肽品种在害虫防控上的研究、开发和应用提供参考和支持。
早在唐代,《本草拾遗》就记载了人们利用蜘蛛毒液治疗鼻衄、金疮和痔疮等疾病。随着分子生物学及相关学科发展,人们逐渐认识到蜘蛛毒液具有多种生理活性,含有多种复杂化学成分。其中,富含二硫键的小分子多肽以其多样化作用机制而成为杀虫剂领域研究开发热点。然而,由于存在半衰期短且易分解、对有害节肢动物毒性不足、生产成本昂贵以及在植物体内表达或进入节肢动物体后容易丧失毒性等问题,这些多肽一直未能作为农药实现商业化。
源自天然蜘蛛毒素前肽裂解的系列多肽物质中,ω/κ-HXTX-Hv1a被认为具有突出的稳定性和害虫毒性特征。由于在蜘蛛毒液中的含量极低而难以富集提取、且基因重组表达的效率和产量又不高,ω/κ-HXTX-Hv1a一直未能实现产业化开发。美国康涅狄格州大学和澳大利亚悉尼工业大学对ω/κ-HXTX-Hv1a的基因进行修饰后重组表达,发现了具有同等高杀虫活性的多肽GS-ω/κ-HXTX-Hv1a。后来,美国韦斯塔隆公司(Vestaron Corporation)采用基因工程技术将甘氨酸-丝氨酸二肽的核苷酸密码子添加至天然蜘蛛毒肽ω/κ-HXTX-Hv1a的基因序列上,再将其连接至合适的表达载体并通过化学方法转化到乳酸克鲁维酵母(Kluyveromyces lactis) YCT306菌株细胞,由此得到的酵母转化体在含甘油的培养基中生长而分泌出多肽GS-ω/κ-HXTX-Hv1a。
这种方法将甘氨酸-丝氨酸二肽连接至天然蜘蛛毒肽的N-端,在保留原有生物活性的同时使高产多肽酵母转化体的数量和多肽的产量都增加。加之乳酸克鲁维酵母菌株也用于食品添加剂乳糖酶等的生产,可有效解决多肽杀虫剂生产成本过高问题。
2014 年,韦斯塔隆公司最先在美国取得VST-006325TGAI(30% GS-ω/κ-HXTX-Hv1a母液)和Spear T(20 g/L GS-ω/κ-HXTX-Hv1a可溶性液剂)的农药登记批准,但直到与意大利微生物发酵合同定制研发生产商卡普阿生物服务公司(Capua Bioservices)达成了有关该多肽杀虫剂的委外生产协议后,GS-ω/κ-HXTX-Hv1a的商业化开发和应用才得以逐步实现。
1. 通用名
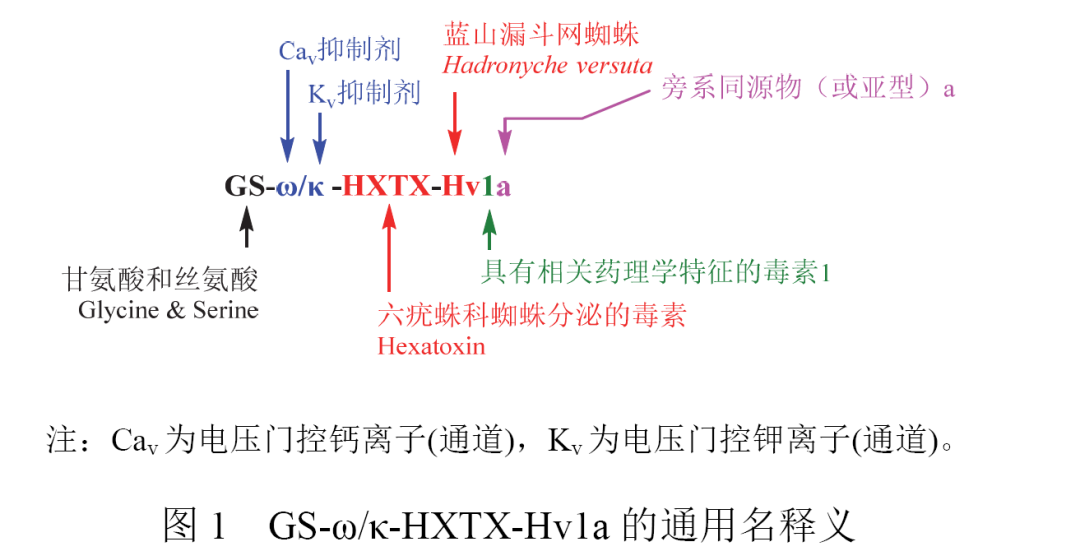
GS-ω/κ-HXTX-Hv1a曾以VersitudeTMpeptide、GS-ω/κ-Hexatoxin-Hv1a、GS-UACTX-Hv1a-SEQ2、GS-U-ACTX-Hv1a-SEQ2、M-ACTX-HV1a+2、rU-ACTX-Hv1a、U-ACTX-Hv1a (“Hybrid”)+2和U+2-ACTX-Hv1a等不同名称被广泛研究报道、开发登记和宣传推广。后来,KING G F等对蜘蛛毒肽及其衍生物的命名进行了梳理,提出广为认可的通用名命名规则并确定了该通用名。根据命名规则,GS-ω/κ-HXTX-Hv1a表明了该多肽杀虫剂的氨基酸序列特点、作用机制、天然来源、药理学特征和旁系同源物(或亚型)类型(图1)。
2. 序列结构
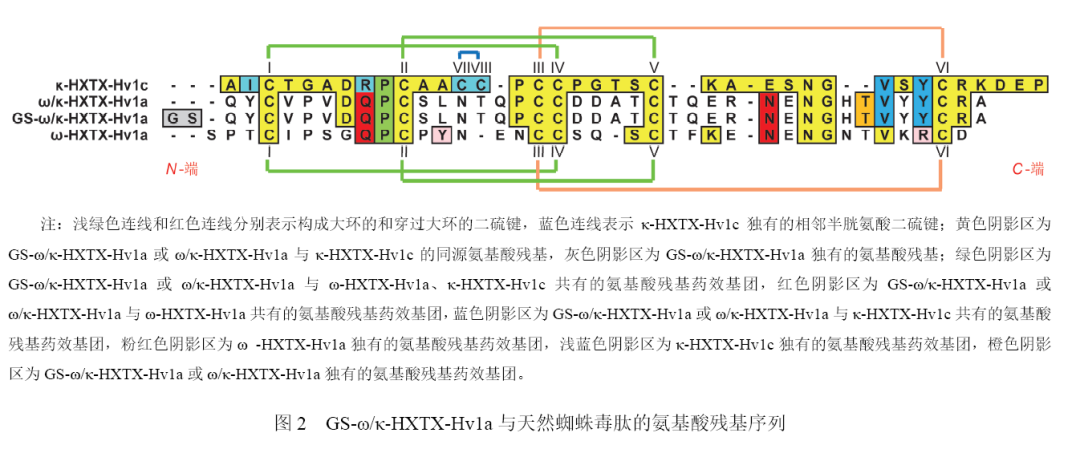
GS-ω/κ-HXTX-Hv1a源自天然蜘蛛毒肽ω/κ-HXTX-Hv1a,含有后者全部的氨基酸序列和药效基团。由于与ω-HXTX-Hv1a和κ-HXTX-Hv1c在基因序列上存在进化关系,GS-ω/κ-HXTX-Hv1a和ω/κ-HXTX-Hv1a都含有一些来自ω-HXTX-Hv1a和κ-HXTX-Hv1c的氨基酸残基,但整体构成上与它们存在较大差异(图2),如不存在κ-HXTX-Hv1c中的相邻半胱氨酸二硫键VII-VIII。GS-ω/κ-HXTX-Hv1a与天然蜘蛛毒肽在氨基酸残基序列等方面的对比见图2和表1。
值得注意的是,这些小分子多肽的氨基酸残基数量都在40左右,分子量在4000上下,大于化学合成类杀虫剂的但小于生物杀虫剂苏云金芽孢杆菌分泌的毒素蛋白的。
与表1中富含二硫键天然蜘蛛毒肽相同,GS-ω/κ-HXTX-Hv1a也属于异源扭结多肽,含有多个半胱氨酸残基和供氢体,具有较高亲水性。其中,每2个相应的半胱氨酸残基通过1个二硫键相连,外围多个二硫键与多肽主链中间部分形成大环,中央一个二硫键穿过该环而形成一个假结,即抑制剂胱氨酸结(Inhibitor Cystine Knot,ICK)。目前尚未见GS-ω/κ-HXTX-Hv1a空间结构的报道,推测其ICK基序结构应与ω-HXTX-Hv1a相似( 图3 为ω-HXTX-Hv1a的ICK基序结构),只是在氨基酸残基序列(图2)、ICK和β-片层的构成等方面存在差异。
在其多肽ICK基序三维结构中,扭转后反向平行的相邻多肽主链(即β-链)上的氨基酸残基通过氢键形成多个β-桥,后者参与构成沿着β-链方向呈锯齿状折叠延伸而形成β-片。同时,由β-链上靠C-端多个半胱氨酸残基分别引出的二硫键紧密地排列在一起,形成了该多肽超稳定的致密疏水(亲脂)中心。由ICK稳定的β-片层即形成了ICK 基序,它使该多肽具有优异的化学性质和稳定性,对酶以及pH、温度、紫外线、有机溶剂和微生物等特殊环境表现出较好的适应性,在节肢动物的血淋巴中也较为稳定。ICK基序的存在保证了GS-ω/κ-HXTX-Hv1a在田间条件下对靶标有害节肢动物防效的稳定性。

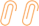
3. 作用机制
(1)对离子通道的作用
注射ω/κ-HXTX-Hv1a或GS-ω/κ-HXTX-Hv1a后,双翅目、鳞翅目、鞘翅目、直翅目、蜚蠊目和蜱螨目等多种类别有害节肢动物都表现出了典型的神经中毒症状,低剂量处理后这些昆虫出现四肢不受控地收缩和行动失衡等过度兴奋症状,接着麻痹和死亡;高剂量处理后快速麻痹和死亡。这不同于ω-HXTX-Hv1a处理后不依赖剂量引起的害虫痉挛性麻痹和死亡。
对美洲大蠊(Periplaneta americana)的研究表明,ω/κ-HXTX-Hv1a通过对神经末梢腹神经节(Terminal Abdominal Ganglion,TAG)上的背侧不成对中间神经元(Dorsal Unpaired Median neuron,DUM)的复杂作用而影响动作电位(Action Potential,AP)的性能,从而影响靶标害虫生存。低剂量处理可增加DUM 自发激活AP的频率,导致害虫过度兴奋;高剂量处理则相反,通过低激活频率引起害虫自发活动减少甚至麻痹。此外,该多肽杀虫剂还可削弱后超极化电位(After Hyperpolariztion Potential,AHP)并延长AP的复极化,促使神经元突触前膜释放神经递质并产生兴奋反应。高剂量处理还可使神经元细胞膜去极化并减少AP的振幅,引起害虫快速麻痹。
ω/κ-HXTX-Hv1a对AP和AHP性能的影响可能与电压门控钙离子(Voltage-gated calcium,Cav)通道和大电导钙离子激活的钾离子(Large conductancecalcium-activated potassium,BKCa)通道分别受到阻塞有关。
全细胞膜片钳研究和蜚蠊BKCa基因的异源表达试验分别证实了该多肽杀虫剂对上述2种离子通道电流的抑制作用。不同的ω/κ-HXTX-Hv1a处理剂量对电流的抑制效果不同,从而对DUM自发激活AP频率产生多种作用:低剂量处理可阻塞BKCa通道以减少AHP幅度而使膜更快地去极化达到AP阈值,高剂量处理可阻塞Cav通道以减缓膜去极化而降低AP的频率。
丙氨酸扫描定点突变研究证实,ω/κ-HXTX-Hv1a的药效基团由Q10(谷氨酰胺)、P11(脯氨酸)、N30(天冬酰胺)、V36(缬氨酸)和Y37(酪氨酸)组成,与ω-HXTX-Hv1a和κ-HXTX-Hv1c存在重叠(图2),同时存在后二者的药效作用。ω/κ-HXTX-Hv1a 对CaV通道电流的抑制作用与ω-HXTX-Hv1a大致相当,但对BKca通道电流的抑制作用略低于κ-HXTX-Hv1c,注射家蝇(Musca domestica)和家蟋蟀(Acheta domestica)的生物活性优于后两者(表2),这说明ω/κ-HXTX-Hv1a对Cav和BKca2种离子通道具有协同增效作用。由于CaV通道和BKca通道都存在于神经元细胞膜上,经过CaV通道的钙离子流也可激活BKca通道,因此Cav通道的阻塞也可加强BKca通道的阻塞。在靶标害虫体内,GS-ω/κ-HXTX-Hv1a对上述2种离子通道的作用机制和效果与ω/κ-HXTX-Hv1a相同或相近。
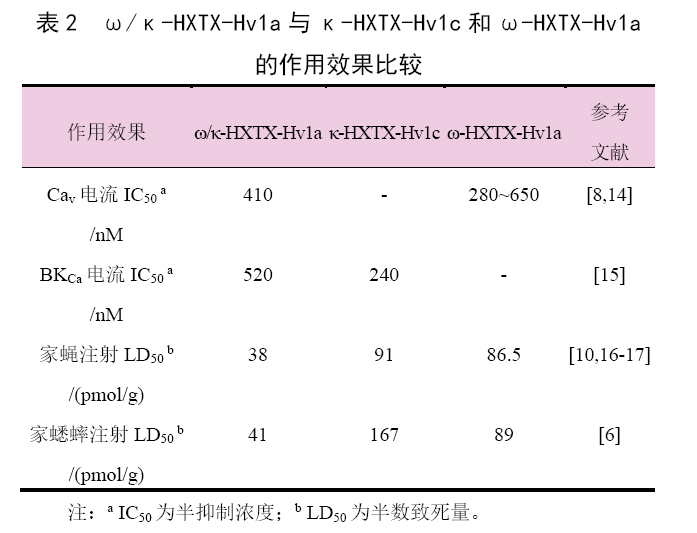
进一步的研究表明,ω-HXTX-Hv1a在100nM和1μM剂量均可大幅度增加美洲大蠊的兴奋性,GS-ω/κ-HXTX-Hv1a仅在1μM剂量时增加了此虫的兴奋性,但都在开始和结束的时候表现出延迟效果。ω-HXTX-Hv1a对家蝇和烟蚜夜蛾(Heliothisvirescens)外周神经肌肉接头上CaV通道无生物活性,但可阻滞家蝇、美洲大蠊和黑腹果蝇(Drosophilamelanogaster)中枢神经系统突触的生理活动,在处理后20~30min引起这3种昆虫不可逆转的痉挛或松弛性麻痹。
GS-ω/κ-HXTX-Hv1a也作用于同样部位的突触而对害虫造成不可逆转的作用,而根据其触杀效果推测还有可能作用于外周神经肌肉接头。此外,GS-ω/κ-HXTX-Hv1a与ω-HXTX-Hv1a对靶标害虫的延迟作用可能与这些多肽穿过血液、大脑的屏障需要一定时间有关。电生理学研究结果显示,CaV通道ω-HXTX-Hv1a和BKca通道调节剂κ-HXTX-Hv1c都具有较好的选择性,对靶标有害节肢动物具有较高活性而对哺乳动物相对安全。ω-HXTX-Hv1a对蜚蠊CaV通道电流具有较强的抑制作用(IC50=650nM),且对中低压门控CaV通道电流抑制作用大于高压门控Cav通道,但在浓度高至10μM时对哺乳动物的L、N 和P/Q亚型CaV通道电流均无作用。κ-HXTX-Hv1c对蜚蠊DUM细胞膜中的钠离子电流、钙离子电流、延迟整流钾离子电流或类似钾离子电流均无作用,但对BKca通道电流具有特异性的抑制作用(IC50=3nM)。
然而,κ-HXTX-Hv1c对大鼠背根神经节(Dorsal RootGanglion,DRG)上的BKCa通道电流则无抑制作用,对异源表达通道电流的抑制作用比蜚蠊的低50多倍。由于起源相关联、序列结构相似以及药效基团重叠,GS-ω/κ-HXTX-Hv1a和ω/κ-HXTX-Hv1a可视为ω-HXTX-Hv1a 和κ-HXTX-Hv1c二者作用机制和效果的加和,也应对哺乳动物具有较高选择安全性。在美国登记的GS-ω/κ-HXTX-Hv1a 产品安全性数据及CLOYD R A等人的研究报道也证实了这一点。
(2)与靶标受体的结合
2018年11月,国际杀虫剂抗性行动委员会将GS-ω/κ-HXTX-Hv1a 作为第1个作用于烟碱乙酰胆碱受体(nicotinic AcetylCholine Receptor,nAChR)位点II 的变构调节剂列入第32组,与同靶标受体的第4组nAChR竞争剂(包括烟碱、吡虫啉、噻虫胺、氟吡呋喃酮、氟啶虫胺腈、三氟苯嘧啶和flupyrimin]等杀虫剂,假定与其具有高亲和性的受体亚型为nAChR1)和第5组作用于nAChR位点I的变构调节剂(包括多杀菌素和乙基多杀菌素等杀虫剂,假定与其优先结合的受体亚型为nAChR2),以及不同靶标受体的其他杀虫剂具有较低的交互抗性风险。
GS-ω/κ-HXTX-Hv1a与环氧虫啶等nAChR拮抗剂的交互抗性情况还有待于进一步研究。通过阻塞轴突髓鞘上CaV通道和BKca通道而抑制其通道电流,GS-ω/κ-HXTX-Hv1a可影响神经递质从突触前膜的释放及在突触后膜与nAChR的结合,使神经传递受阻而影响靶标害虫的正常生理活动和生存。特异性配体亲和性试验研究表明,ω-HXTX-Hv1a对nAChR2的选择性比nAChR1 更明显,而GS-ω/κ-HXTX-Hv1a和κ-HXTX-Hv1c 可高亲和性地对ω-HXTX-Hv1a进行取代,同时还可增加靶标受体对吡虫啉的亲和力。
这说明GS-ω/κ-HXTX-Hv1a可与神经元突触后膜上的nAChR结合并通过正性变构调节而使害虫表现出神经兴奋效应。最新的研究表明,GS-ω/κ-HXTX-Hv1a对脱敏型烟碱乙酰胆碱受体(Desensitizing nicotinic AcetylCholine Receptor ,nAChDR)敏感,而对非脱敏型烟碱乙酰胆碱受体(Non-desensitizing nicotinic AcetylCholine Receptor,nAChNR)不敏感,这与nAChR竞争调节剂一致而与作用于nAChR 位点I的变构调节剂相反。
同时,GS-ω/κ-HXTX-Hv1a对nAChDR相关通道电流存在复杂的作用:在亚纳摩尔浓度下表现出抑制作用,而在30nmol/L及以上浓度时激活和增强烟碱乙酰胆碱诱发的电流。然而,也有一些细胞的nAChDR对GS-ω/κ-HXTX-Hv1a的作用并没有响应。
4. 生物活性
室内生测和田间药效试验结果表明,GS-ω/κ-HXTX-Hv1a对捕食性蜘蛛的猎物如鳞翅目、鞘翅目、双翅目、半翅目和蜚蠊目等类别的节肢动物均具有较好生物活性。
(1)室内活性
GS-ω/κ-HXTX-Hv1a的生物活性与天然蜘蛛毒肽ω/κ-HXTX-Hv1a 相当,但不同处理方式和稀释溶剂会影响其稳定性而对其活性产生较大影响。GS-ω/κ-HXTX-Hv1a对家蝇的注射LD50为76.8~81.5pmol/g,与相同条件下ω/κ-HXTX-Hv1a (LD50=77.6pmol/g)相当,但略低于ω-HXTX-Hv1a (LD50=90.2 pmol/g)。
与进入虫体后被代谢分解等因素有关,GS-ω/κ-HXTX-Hv1a注射的活性远优于饲喂和喷洒的活性。
100mg/L 注射家蝇后5h的致死率为10%,10g/L饲喂南方玉米根虫(Diabroticaundecimpunctata)幼虫后4d的致死率为22%,8g/L喷洒处理拟步甲(Alphitobius diaperinus)致死率为74%。
ω/κ-HXTX-Hv1a 的乙醇-二甲基亚砜溶液对家蝇进行局部处理也具有杀虫活性,且处理腹侧的杀虫速度和效果与处理胸背相似或更高,但用水稀释该溶液则会降低甚至完全抑制其活性。GS-ω/κ-HXTX-Hv1a的杀虫活性还与有害节肢动物的龄期和处理时间有关,一般对低龄虫比高龄虫更有效,与苏云金芽孢杆菌库斯塔克菌种(Bacillusthuringiensis kurstaki,Btk)等其他作用机制杀虫剂混用具有协同增效作用。
室内生测结果表明,GS-ω/κ-HXTX-Hv1a对低龄甜菜夜蛾(Spodopteraexigua)药后72~96h的致死率显著低于24~48h,与Btk 混用后对甜菜夜蛾、拟步甲、蚊、马铃薯甲虫(Leptinotarsa decemlineata)和耐苏云金芽孢杆菌的小菜蛾(Plutella xylostella)等都具有显著协同增效作用,可使药后72~96h的致死率优于24~48h的或增效2.8倍以上。
与Btk相似,GS-ω/κ-HXTX-Hv1a单独处理对高龄甜菜夜蛾无效,这可能与高龄害虫产生复杂的肠道蛋白酶使其水解有关。加入合适助剂或增效剂可以增强GS-ω/κ-HXTXHv1a对靶标害虫的生物活性,但诱食剂对其活性影响相对有限。由于进入害虫后容易被水解或分解,该多肽杀虫剂的杀虫效果不如化学合成类杀虫剂。GS-ω/κ-HXTX-Hv1a 残留局部处理对日本斑翅果蝇(Drosophila suzukii)成虫72h的致死率仅为17.5%,分别与改性有机硅聚醚类润湿剂Silwet L-77和LeafLife Widespread、甲基化植物油类增效剂MSO、牛脂胺聚氧乙烯醚类增效剂WaterGuard 及卵磷脂类增效剂LI-700混合后局部处理或残留局部处理日本斑翅果蝇,或浸果处理对降低害虫成虫或其子代存活率具有不同程度增效作用。
除了助剂或增效剂本身对靶标害虫的毒性等因素,这还与它们可有效地辅助GS-ω/κ-HXTX-Hv1a的铺展、润湿和渗透害虫角质层而发挥作用有关。GS-ω/κ-HXTX-Hv1a与助剂LI-700或Silwet L-77混用对日本斑翅果蝇成虫及其后代种群的控制作用要优于与诱食剂赤藓糖醇混用,但却都不如zeta-氯氰菊酯单用的。GS-ω/κ-HXTX-Hv1a与蔗糖诱食剂和/或苏云金芽孢杆菌以色列亚种(Bacillusthuringiensis isroelensis,Bti)混合饲喂日本斑翅果蝇对其成虫及后代存活的影响也相对有限。
(2)田间药效
GS-ω/κ-HXTX-Hv1a对椿象、大头虫和日本斑翅果蝇等害虫具有较好的田间防效,可与化学合成类杀虫剂相媲美。20g/L GS-ω/κ-HXTX-Hv1a 可溶性液剂田间药效试验结果显示:以16.8 L/hm2在豆荚灌浆期施用虽不能阻止绿椿象(Chinavia hilaris)和褐斑椿象(Halyomorpha halys)对日本毛豆豆荚的损害,但可有效减少椿象种群数量,其防效与氟啶虫胺腈、氟吡呋喃酮和环溴虫酰胺相近,且对作物安全;以28.1L/hm2施用对日本毛豆田间的大头虫(Alydus eurinus)成虫也有较好防效;以27.6L/hm2施用可有效减少高丛越橘田间的日本斑翅果蝇数量,其防效与亚胺硫磷相当;以28.6 L/hm2施用虽不能杀死蓝莓的日本斑翅果蝇成虫,但可有效减少成虫羽化。然而,GS-ω/κ-HXTX-Hv1a与含诱食剂的粉色SPLAT助剂(ACTTRA SWD TD)混合施用反而使日本斑翅果蝇成虫的羽化率超过了对照。不同作用机制杀虫剂交替使用可减少害虫对特定作用机制杀虫剂的依赖。
然而,GS-ω/κ-HXTX-Hv1a与多杀菌素类杀虫剂交替施用时,即使加入玉米糖浆也不能有效地控制日本斑翅果蝇;与zeta-氯氰菊酯按7d轮换施用对蓝莓的日本斑翅果蝇的防效与常规的相近,同时对作物无药害,但7d后防效不显著。根据相关产品在美国环保署(USEPA)的登记标签说明,GS-ω/κ-HXTX-Hv1a制剂的药液配制、施用方式和时间等多种因素对其田间防效至关重要。为获得最佳防治效果,应将GS-ω/κ-HXTX-Hv1a药液即配即用,于害虫侵染早期或幼虫孵化初期对作物进行全覆盖的均匀喷雾。
5. 安全性
GS-ω/κ-HXTX-Hv1a及其主要生产原料具有较高安全性,对哺乳动物和生态环境具有较低的毒性或风险。生产发酵用的乳酸克鲁维酵母菌株广泛用于食品添加辅料的生产,其本身无致病性和毒性,副产物也不会造成风险,细胞培养发酵对哺乳动物也没有影响。急性毒性试验结果表明,GS-ω/κ-HXTX-Hv1a在最高施用剂量下对哺乳动物、鸟、鱼和水生生物无致死作用,对蜜蜂也无显著影响和半致死作用,在浓度1000mg/L和100mg/L时分别对鳟鱼和大型溞无毒性作用,在剂量高至896.7g/hm2也未观察到对植物出苗和营养活力的毒害作用。同时,GS-ω/κ-HXTX-Hv1a对西花蓟马(Frankliniella occidentalis)的天敌小花蝽(Orius insidiosus)成虫的存活力和捕食能力无不利影响,对隐翅虫(Dalotia coriaria)也无直接毒害作用。
由于缺乏毒性作用而对脊椎动物实际无毒,USEPA 豁免了登记该多肽杀虫剂所需要提交的致癌、生殖、发育和免疫毒性,对内分泌功能和水生生物的影响,以及环境归宿和转移等方面的测试数据。USEPA 估算GS-ω/κ-HXTX-Hv1a在田间条件下半衰期为4d,鉴于多肽和蛋白质的生物活性与特定的结构和构型相关,该多肽杀虫剂在进入环境后很可能会受水溶液和pH等因素影响而快速丧失活性。
20g/L GS-ω/κ-HXTX-Hv1a可溶性液剂的登记要求该产品须在稀释后24h内施用,也说明该多肽杀虫剂遇水后不会长时间有效。USEPA规定该制剂最高年施用量不超过2.8L,根据标准池2.0×107L容积计算所得的预期环境浓度(Expected Environmental Concentration,EEC) 0.002 8mg/L远低于毒性测试值。加上田间暴露半衰期很短,GS-ω/κ-HXTX-Hv1a在环境中快速降解而不会达到对非靶标生物产生风险的浓度。
生物杀虫剂具有杀虫谱广、环境相容性好、不易产生抗药性等优点,可广泛应用于害虫综合治理和抗性管理。作为一种新型的多肽类生物杀虫剂,GS-ω/κ-HXTX-Hv1a生产成本经济,且具有独特的ICK 基序稳定结构、协同的双重作用机制、全新的靶标作用位点、优异的非靶标安全性和环境相容性等特征,在害虫绿色防控、昆虫病原体改良、转基因作物开发等方面具有广阔的应用前景。同时,GS-ω/κ-HXTX-Hv1a的研究应用还可为蜘蛛毒肽类农药的创制开发提供指导和支持。
1. 害虫绿色防控
作为为数不多的作用机制明确的生物杀虫剂,GS-ω/κ-HXTX-Hv1a具有双重的作用机制和全新的靶标作用位点,与现有杀虫剂无交互抗性,加之其广谱的杀虫活性,有望成为一种重要的害虫综合治理和抗性防治新工具。基于活性成分GS-ω/κ-HXTX-Hv1a,韦斯塔隆公司已相继开发出了3个Spear™系列产品。其中,单剂Spear™-T以触杀作用为主,主要用于温室蓟马和粉虱的防控;与Btk的复配Spear™-C以胃毒作用为主,主要用于毛毛虫的防控;与苏云金芽孢杆菌粉甲亚种(Bacillus thuringiensistenebrionis,Btt)的复配SPEAR™-P兼具触杀和胃毒作用,主要用于马铃薯甲虫的防控。
由于对包含作物在内的非靶标生物安全,施用后的限制进入时间间隔(Re-Entry Interval,REI)和安全间隔期(PlantHarvest Interval,PHI)分别仅为4h和0d,Spear™-T在食品中的最大残留限量(Maximum ResiduesLimit,MRL)得到了USEPA 的豁免,并在2016 年通过了荷兰国际园艺行业的“更有利可持续性(More Profitable Sutainability,MPS)”认证,在2020年还获得USEPA 评选的“绿色化学挑战奖(Green Chemistry Challenge Awards)”。2017 年,韦斯塔隆公司在美国又登记了VST-006330 EP (20%GS-ω/κ-HXTX-Hv1a可溶性液剂)和VST-006335 MP(30 g/L GS-ω/κ-HXTX-Hv1a可溶性液剂)等制剂产品,用于温室蓟马、粉虱和二点斑叶螨等顽固性害虫的绿色防控。由于同时兼顾了药效、安全性(特别是对蜜蜂等传粉昆虫的低毒性) 与可持续性,GS-ω/κ-HXTX-Hv1a单用或者与新烟碱类杀虫剂等杀虫剂混用可用于鳞翅目、半翅目、鳞翅目、鞘翅目和蜱螨目等多种类别害虫的绿色防控,其研究和应用开发前景广阔。
2. 昆虫病原体改良
通过基因重组表达将含有GS-ω/κ-HXTX-Hv1a的害虫特异性多肽编码基因引入昆虫病原真菌和杆状病毒等特异性寄主体内,可显著降低生防制剂施用剂量,提升对靶标害虫的作用速度和防治效果,避免对非靶标生物不利影响。将GS-ω/κ-HXTX-Hv1a的编码基因插入蝗虫绿僵菌(Metarhizium acridum)可使后者对蝗虫的致死剂量降低、杀灭时间缩短,蝗虫对作物的取食消耗也相应减少。
而将该编码基因植入平沙绿僵菌(M. pingshaense)则可使后者对敏感系和抗性系的非洲疟疾媒介冈比亚按蚊(Anopheles gambiae)和科鲁兹按蚊(A.coluzzii)的致死率和击倒时间得到显著改善,疟蚊飞行能力减弱,采血行为减少,疾病传播能力降低,同时结合氯菊酯等现有杀虫剂施用对蚊虫控制还具有显著增效作用。
将GS-ω/κ-HXTX-Hv1a与钠离子通道阻滞剂黄肥尾蝎(Androctonus australis)毒素AaIT1共同进行重组后于病原真菌中表达可显著增强其生物活性:重组基因在蝗虫绿僵菌体内表达可使生防真菌对蝗虫的LC50、LT50和作物消耗分别降低11.5倍、43%和78%,在平沙绿僵菌体内表达可将杀灭一半疟蚊所需的孢子剂量减少45% (5d)。可能受特异性在空间和时间上与转基因表达分离的表皮层反应不同等因素的影响,绿僵菌等昆虫病原体的寄生特异性在重组表达后也得以保留。这就使得靶标害虫的范围由昆虫病原体而不是由多肽决定,从而避免了对非靶标生物的致病性。换言之,GS-ω/κ-HXTX-Hv1a编码基因插入昆虫病原体在改良后者毒性效应的同时,也赋予了自身更好的选择性和更广泛的用途。
随着GS-ω/κ-HXTX-Hv1a编码基因单独植入或与其他基因共同植入蝗虫绿僵菌和平沙绿僵菌并用于农业害虫和卫生虫媒防控取得成功,其在杆状病毒等其他昆虫病原体上的研究和应用也值得期待。
3. 转基因作物开发
GS-ω/κ-HXTX-Hv1a编码基因序列插入农作物,有望设计出类似苏云金芽孢杆菌杀虫晶体蛋白(cry)的转基因作物,从而赋予农作物更好的抗虫耐受力,使害虫生长和活动受到抑制并引起其死亡,或减少害虫危害而最终实现作物增产。GS-ω/κ-HXTX-Hv1a 杀虫谱广、作用机制和靶标位点与现有杀虫剂不同,其转基因作物对苏云金芽孢杆菌等杀虫剂敏感和耐受的害虫均有效。
GS-ω/κ-HXTX-Hv1a为多肽物质,在哺乳动物体内容易被相关酶所分解,在环境中也会受到pH、温度、紫外线和微生物等影响而被降解,使得该类转基因作物具有较高的安全性。虽然目前尚未见GS-ω/κ-HXTX-Hv1a编码基因序列农作物的研究报道,可以预见该多肽杀虫剂作为转基因作物研究开发具有巨大潜力。
4. 新农药创制
作为一种全新的生物杀虫剂,GS-ω/κ-HXTX-Hv1a的成功开发为新农药创制提供了新的思路和指导,对GS-ω/κ-HXTX-Hv1a进行化学修饰或生物融合有望加强其效能,促进同类杀虫剂研究开发。一方面,对GS-ω/κ-HXTX-Hv1a进行化学修饰或改性可提高其生物活性和药效稳定性,如温度和pH变化引起的GS-ω/κ-HXTX-Hv1a脱水和/或脱氨,以及进一步的肼解,可增强或提高其亲脂性和杀虫活性。研究表明,GS-ω/κ-HXTX-Hv1a脱水产物内酯(图4 化合物II)10g/L对南方玉米根虫饲喂后4d的致死率比GS-ω/κ-HXTX-Hv1a增加4倍多,进一步肼解产物酰肼(图4 化合物III) 100mg/L 对家蝇注射后5h的致死率也比GS-ω/κ-HXTX-Hv1a增加8倍左右。

另一方面,与其他多肽或蛋白融合可提高GS-ω/κ-HXTX-Hv1a 穿过有害节肢动物肠道上皮细胞进入血淋巴、到达中枢神经系统作用位点的效率,在不影响其对非靶标生物安全性的同时增加对靶标害虫的生物活性。将天然蜘蛛毒素ω-HXTX-Hv1a或地窖蛛(Segestria florentina)毒素SFI1融合至运载蛋白雪花莲凝集素(Galanthus nivalis agglutinin,GNA)可有效提高对靶标害虫甘蓝夜蛾(Mamestrabrassicae)、水稻褐飞虱(Nilaparvata lugens)和桃蚜(Myzus persicae)的急性经口毒性,并引发发育延缓、繁殖能力降低等半致死效应,同时对传粉昆虫蜜蜂的存活、嗅觉学习和记忆能力等无不利影响。
作为上述2种毒素多肽的类似物,将GS-ω/κ-HXTX-Hv1a融合至GNA 等功能性蛋白有望实现相似的作用效果,从而实现对靶标害虫更有效的控制。
含有ICK基序的蜘蛛毒肽及其衍生物是一种相对稳定的多肽或微型蛋白质,通过作用于神经元离子通道和靶标受体使有害节肢动物快速表现出神经中毒症状,并逐步丧失活动能力直至最终死亡。它们不仅具有潜在经口毒性,还可在雾化后透过体表从气孔进入害虫体内而发挥触杀作用,可作为杀虫剂单独施用。源自澳大利亚漏斗网蜘蛛的新型多肽杀虫剂GS-ω/κ-HXTX-Hv1a的成功开发,有力证实多肽可直接作为生物农药进行商业化开发和应用。
作为天然蜘蛛毒肽ω/κ-HXTX-Hv1a的一种重要衍生物,GS-ω/κ-HXTX-Hv1a在工业上可由其编码基因修饰后的酵母转化体分泌生产获得。用GS-ω/κ-HXTX-Hv1a替代ω/κ-HXTX-Hv1a进行开发,不仅保持了天然毒肽的杀虫活性,还显著地提高了发酵生产产量,生产成本更经济,但GS-ω/κ-HXTX-Hv1的含量和产量还有进一步提升的空间。有关该多肽杀虫剂规模化生产的基因重组与表达、纯化与分离制备等还鲜见报道,如何进一步提高其产量品质并降低生产成本值得深入研究。
GS-ω/κ-HXTX-Hv1a对靶标害虫的神经系统神经元CaV和BKca2种离子通道具有协同的双重作用机制,对靶标受体及其位点也与现有的杀虫剂不同,对非靶标生物也具有较高的安全性,在农业和公共卫生领域的害虫防控上具有广阔的应用前景。从GS-ω/κ-HXTX-Hv1a 的室内生测和田间试验结果来看,无论是单独处理还是与助剂或其他杀虫剂混合或轮换施用,其药效、稳定性都还有待于进一步提高、改善。该产品在非农领域的用途也有待开拓,建议从以下几个方面促进或加强GS-ω/κ-HXTX-Hv1a的研究和应用开发:
(1)筛选具有分散、润湿、渗透和稳定等作用的功能性助剂及其混用配比,促进GS-ω/κ-HXTX-Hv1a透过害虫表皮进入体内与靶标位点结合,增强药剂的耐雨水冲刷和抗紫外线等性能,提升药效稳定性。GS-ω/κ-HXTX-Hv1a水中稳定性较低,通过改进剂型以提高其药效稳定性也具有重要意义。
(2)开发与其他作用机制生物农药或化学农药的复配,通过不同作用机制协同发挥增效作用、扩大杀虫谱和延缓害虫抗药性。如与Btk 或Btt复配对GS-ω/κ-HXTX-Hv1a穿过肠道可起到促进作用,而多重的作用机制和作用位点又使其药效得以叠加增强,杀虫谱得以扩大。
(3)开发与GS-ω/κ-HXTX-Hv1a特点相适应的使用技术和生产实践,选择合适的施用方法、时间和轮换策略,结合多种防治措施对多种害虫进行综合治理和抗性管理,延长产品的生命周期。
作为一种农药新竞品,需要具备更经济的生产成本、更短的环境持久性、更高的经口/接触生物利用度和效能、更高的田间稳定性、更便捷的施用方法,以及更低的非靶标生物毒性和非致死作用等优势。为了成为实际可用的害虫治理新工具并在市场上占有一席之地, 加强、深化并拓展GS-ω/κ-HXTX-Hv1a在生产研发、害虫绿色防控、昆虫病原体改良、转基因作物开发和新农药创制等研究和应用方面的创新性开发就显得尤为重要。随着公众对安全健康和环境生态的关注、农药减量增效和保护生物多样性等行动的开展以及生物农药的迅猛发展,GS-ω/κ-HXTX-Hv1a及同类蜘蛛毒肽类生物农药的未来发展可期。
来源:《世界农药》2022年第7期