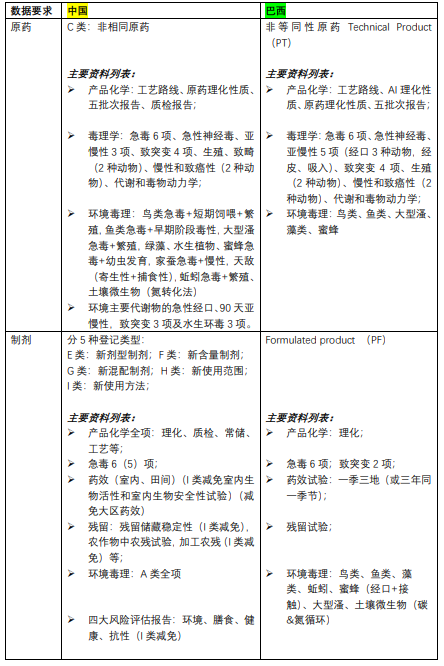
第二,对实验室的资质要求:
巴西要求试验报告出自OECD GLP实验室;
中国要求试验报告出自通过农业农村部试验单位资质认定的实验室。
残留、药效试验两国都要求必须在当地进行。
第三,对实验指南的要求:
巴西要求试验遵循OECD指南及巴西ABNT NBR指南;另外针对急毒6项中的皮肤刺激性、眼刺激性和皮肤致敏试验,巴西要求境内实验室必须用替代实验,不接受动物实验。
中国要求试验遵循国标、行标指南。
第四,对资料的语言要求:
巴西:葡萄牙语报告为主,如果是英文报告,要求摘要部分翻译为葡语。
中国:要求中文报告。查询的英文资料必须有中文翻译件。
总结:
经过以上比较,大致可得出结论:现阶段巴西和中国农药登记数据互认基本是不可能的。除了药效和残留都必须当地完成,资料要求差异也比较大。即使资料要求相同的部分,比如部分产品化学、毒理、环毒报告,按巴西要求,国内200多家试验单位中仅有不到10家同时也是OECD GLP实验室(毒理仅有1家)。按中国要求,巴西实验室或巴西以外的GLP实验室,都没有通过农业农村部的试验单位资质认定。即使巴西政府可以接受中国实验室的报告,用于中国登记的报告所遵循的国行标指南还是不能符合巴西对报告的指南要求。另一方面,即使中国政府能接受巴西实验室完成的实验报告,仍有很多资料需要在本国补充完成。
但是,对于非新农药原药(非等同性原药),无论是从动物福利的角度,还是出于为登记企业减负的考虑,如果毒理学报告能够互认,不用多花几百万元重复做两套报告(尤其慢性&致癌性实验),还是很值得呼吁和期待的。
总而言之,当前阶段说“互认”还为时过早,静待两国政府相关主管部门之间的进一步沟通和协商结果吧!对于企业来说,目前想要实现农药登记数据在巴西和中国两国的通用,应尽量选择既有OECD GLP资质,又通过农业农村部农药登记试验单位资质认定的实验室(即双资质实验室,如北京颖泰分析、沈化院等单位),至少可以先实现原药五批次全分析、理化和制剂理化、环毒等试验报告的共用,为企业节省一部分试验费用。
最后,假如将来巴西和中国农药登记数据互认协议达成,根据两国登记要求的异同,可归纳一下:
可以互认/共用的数据:五批次全分析、理化报告、毒理报告、部分环毒报告(鸟鱼溞藻蜜蜂蚯蚓和土壤微生物氮转化)
无法互认/共用的数据:残留、药效、部分环毒报告(如家蚕等巴西不需要)、风险评估等。
来源:颖泰分析